
- •Раздел 1
- •Глава 1
- •Кристаллические и аморфные тела
- •Элементы кристаллографии
- •Кристаллическая решетка
- •Кристаллографические индексы
- •Анизотропия
- •Влияние типа связи на структуру и свойства кристаллов
- •Взаимодействие частиц в кристаллах
- •Молекулярные кристаллы
- •Ковалентные кристаллы
- •Металлические кристаллы
- •Ионные кристаллы
- •Фазовый состав сплавов
- •Твердые растворы
- •Промежуточные фазы
- •Системы металл — неметалл
- •Дефекты кристаллов
- •Точечные дефекты
- •Линейные дефекты
- •Поверхностные дефекты
- •Жидкие кристаллы
- •Структура неметаллических материалов
- •Строение полимеров
- •Строение стекла
- •Строение керамики
- •Глава 2 свойства материалов
- •Критерии выбора материала
- •Механические свойства материалов
- •Механические свойства, определяемые при статических нагрузках
- •Механические свойства, определяемые при динамических нагрузках
- •Механические свойства, определяемые при переменных (циклических) нагрузках
- •Физические свойства материалов
- •Глава 3
- •Самопроизвольная кристаллизация
- •Несамопроизвольная кристаллизация
- •Форма кристаллов и строение слитков
- •Получение монокристаллов
- •Аморфные металлы
- •Нанокристаллические материалы
- •Глава 4
- •Методы построения диаграмм состояния
- •Основные равновесные диаграммы состояния двойных сплавов
- •Диаграмма состояния сплавов, компоненты которых полностью растворимы в жидком и твердом состояниях
- •Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику
- •Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют перитектику
- •Диаграмма состояния сплавов с полиморфным превращением одного из компонентов
- •Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением
- •Физические и механические свойства сплавов в равновесном состоянии
- •Диаграмма состояния железоуглеродистых сплавов
- •Компоненты и фазы в сплавах железа с углеродом
- •Превращения в сплавах системы железо — цементит
- •Превращения в сплавах системы железо — графит
- •Влияние легирующих элементов на равновесную структуру сталей
- •Легирование и фазовые превращения
- •Карбиды и нитриды в легированных сталях
- •Влияние легирующих элементов на фазовые превращения сталей
- •Диаграмма состояния тройной системы
- •Глава 5 формирование структуры деформированных металлов и сплавов
- •Пластическое деформирование моно- и поликристаллов
- •Механизм пластического деформирования
- •Особенности деформирования монокристаллов
- •Деформирование поликристаллов
- •Деформирование двухфазных сплавов
- •Свойства холоднодеформированных металлов
- •Возврат и рекристаллизация
- •Раздел 2
- •Глава 6
- •Виды термической обработки
- •Диффузия в металлах и сплавах
- •Вывод первого уравнения Фика на основе атомной теории диффузии
- •Вывод уравнений Фика на основе термодинамической теории диффузии
- •Зависимость коэффициента диффузии от температуры
- •Диффузия в металлах и полимерах
- •Термическая обработка сплавов, не связанная с фазовыми превращениями в твердом состоянии
- •Нагрев для снятия остаточных напряжений
- •Рекристаллизационный отжиг
- •Диффузионный отжиг (гомогенизация)
- •Термическая обработка сплавов с переменной растворимостью компонентов в твердом состоянии
- •Термическая обработка сталей
- •Превращения в сталях при нагреве до аустенитного состояния
- •Превращения аустенита при различных степенях переохлаждения
- •Основные виды термической обработки стали
- •Отжиг сталей
- •Нормализация сталей
- •Особенности закалки сталей
- •Закаливаемость и прокаливаемость сталей
- •Отпуск закаленных сталей
- •Оборудование для термической обработки
- •Глава 7
- •Общие закономерности
- •Диффузионное насыщение стальных деталей углеродом и азотом
- •Цементация стали
- •Насыщение поверхности стали одновременно углеродом и азотом
- •Ионная химико-термическая обработка сплавов
- •Диффузионное насыщение деталей металлами и неметаллами. Циркуляционный метод химико-термической обработки
- •Перспективы развития химико-термической обработки
- •Раздел 3
- •Глава 8
- •Общие требования, предъявляемые к конструкционным материалам
- •Конструкционная прочность материалов и критерии ее оценки
- •Методы повышения конструкционной прочности
- •Классификация конструкционных материалов
- •Глава 9
- •Классификация конструкционных сталей
- •Влияние углерода и постоянных примесей на свойства сталей
- •Углеродистые стали
- •Углеродистые стали обыкновенного качества
- •Углеродистые качественные стали
- •Легированные стали
- •Маркировка легированных сталей
- •Легированные машиностроительные стали Назначение легирования
- •Глава 10 материалы с особыми технологическими свойствами
- •Стали с улучшенной обрабатываемостью резанием
- •Железоуглеродистые сплавы с высокими литейными свойствами
- •Разновидности чугунов
- •Серые чугуны
- •Высокопрочные чугуны
- •Чугуны с вермикулярным графитом
- •Ковкие чугуны
- •Медь и ее сплавы
- •Свойства меди
- •Общая характеристика и классификация медных сплавов
- •Бронзы Оловянные бронзы
- •Глава 11 износостойкие материалы
- •Характеристики износа и виды изнашивания
- •Закономерности изнашивания деталей, образующих пары трения, и пути уменьшения их износа
- •Материалы с высокой твердостью поверхности
- •Материалы, устойчивые к абразивному изнашиванию
- •Материалы, устойчивые к
- •Материалы, устойчивые к изнашиванию в условиях больших давлений и ударных нагрузок
- •Антифрикционные материалы
- •Фрикционные материалы
- •Глава 12
- •Основные требования к пружинным материалам
- •Рессорно-пружинные стали
- •Материалы для упругих элементов приборостроения
- •Глава 13 материалы с малой плотностью
- •Особенности материалов с малой плотностью
- •Алюминий и его сплавы
- •Свойства алюминия
- •Общая характеристика алюминиевых сплавов
- •Деформируемые алюминиевые сплавы
- •Литейные алюминиевые сплавы
- •Гранулированные сплавы
- •Сплавы на основе магния
- •Свойства магния
- •Общая характеристика магниевых сплавов
- •Деформируемые магниевые сплавы
- •Литейные магниевые сплавы
- •Неметаллические материалы
- •Пластмассы Общая характеристика
- •Глава 14 материалы с высокой удельной прочностью
- •Титан и сплавы на его основе
- •Свойства титана и его сплавов
- •Влияние легирующих элементов на структуру и свойства титановых сплавов
- •Особенности термической обработки титановых сплавов
- •Легирующий элемент, %
- •Промышленные титановые сплавы
- •Бериллий и сплавы на его основе
- •Свойства бериллия
- •Бериллиевые сплавы
- •Композиционные материалы
- •Общая характеристика
- •Дисперсно-упрочненные композиционные материалы
- •Волокнистые композиционные материалы Структура и свойства
- •Композиционные материалы на неметаллической основе
- •Композиционные материалы на металлической основе
- •Гибридные композиционные материалы
- •Глава 15 материалы, устойчивые к воздействию температуры и рабочей среды
- •Коррозионно-стойкие материалы
- •Электрохимическая коррозия металлов
- •Коррозионно-стойкие непассивирующиеся металлы
- •Коррозионно-стойкие пассивирующиеся металлы
- •Коррозионно-стойкие стали
- •Коррозионно-стойкие покрытия
- •Жаростойкие материалы
- •Химическая коррозия металлов
- •Жаростойкость металлов
- •Жаростойкость сплавов
- •Жаропрочные материалы
- •Критерии жаропрочности материалов
- •I неустановившаяся стадия; II - установившаяся стадия; III - стадия разрушения
- •Основные группы жаропрочных материалов
- •Хладостойкие материалы
- •Критерии хладостойкости материалов
- •Основные группы хладостойких материалов
- •Радиационно стойкие материалы
- •Влияние облучения на структуру и механические свойства
- •Влияние облучения на коррозионную стойкость
- •Раздел 4
- •Глава 16 материалы с особыми магнитными свойствами
- •Общие сведения о ферромагнетиках
- •Магнитомягкие материалы
- •Низкочастотные магнитомягкие материалы
- •41 После отжига в поперечном магнитном поле. *2То же в продольном магнитном поле. *3То же без наложения магнитного поля.
- •Высокочастотные магнитомягкие материалы Общая характеристика ферритов
- •Материалы со специальными магнитными свойствами
- •Магнитотвердые материалы
- •Основные требования к магнитотвердым материалам
- •Магнитотвердые литые материалы
- •Порошковые магнитотвердые материалы
- •Деформируемые магнитотвердые сплавы
- •Глава 17
- •Сплавы с заданным температурным коэффициентом линейного расширения
- •Сплавы с заданным температурным коэффициентом модуля упругости
- •Глава 18
- •Материалы с высокой электрической проводимостью
- •Строение и свойства проводниковых материалов
- •Промышленные проводниковые материалы
- •Полупроводниковые материалы
- •Строение и свойства полупроводниковых материалов
- •Методы получения сверхчистых материалов
- •- Затравка; 3 - монокристалл; 4 - расплав полупроводника
- •Раздел 5
- •Глава 19
- •Материалы для режущих инструментов
- •Углеродистые стали
- •Низколегированные стали
- •Быстрорежущие стали
- •Порошковые твердые сплавы
- •Сверхтвердые материалы
- •Стали для измерительных инструментов
- •Глава 20 стали для инструментов обработки металлов давлением
- •Стали для инструментов холодной обработки давлением
- •Стали для инструментов горячей обработки давлением
- •Предметный указатель
- •Х 326 арактеристика износа и виды изнашивания
- •Московское машиностроительное производственное предприятие “Салют”
- •5 Пери (греч.) — вокруг
- •8 Особенности термической обработки некоторых магнитных сплавов будут рассмотрены в гл. 16.
Глава 3
ФОРМИРОВАНИЕ СТРУКТУРЫ ЛИТЫХ МАТЕРИАЛОВ
Переход металла из жидкого или парообразного состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией.
Образование новых кристаллов в твердом кристаллическом веществе называется вторичной кристаллизацией. Процесс кристаллизации состоит из двух одновременно идущих процессов — зарождения и роста кристаллов. Кристаллы могут зарождаться самопроизвольно — самопроизвольная кристаллизация — или расти на имеющихся готовых центрах кристаллизации — несамопроизвольная кристаллизация.
Самопроизвольная кристаллизация
Самопроизвольная кристаллизация обусловлена стремлением вещества иметь более устойчивое состояние, характеризуемое уменьшением термодинамического потенциала С.
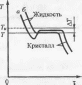
С повышением температуры термодинамический потенциал вещества как в твердом, так и в жидком состоянии уменьшается, что показано на рис. 3.1.
Температура, при которой термодинамические потенциалы вещества в твердом и жидком состояниях равны, называется равновесной температурой кристаллизации. Кристаллизация происходит в том случае, если термодинамический потенциал вещества в твердом состоянии будет меньше термодинамического потенциала вещества в жидком состоянии, т.е. при переохлаждении жидкого металла до температур ниже равновесной. Плавление — процесс, обратный кристаллизации, происходит при температуре выше равновесной, т.е. при перегреве. Разница между реальными температурами плавления и кристаллизации называется температурным гистерезисом.
Поскольку жидкий металл обладает большей внутренней энергией, чем твердый, при кристаллизации выделяется теплота. Между теплотой (5 и температурой кристаллизации Тк существует определенная связь. Так как при равновесной температуре кристаллизации термодинамические потенциалы в жидком и твердом состояниях равны, из формулы (1.1) следует, что
Д//ж — ТКА8Ж = ДЯК — ТКД5К;
АНЖ - АНК = ТК(Д5ж - Д5К); д = ТКД5.
Параметр Д51 = ф/Тк характеризует упорядоченность в расположении атомов при кристаллизации. В зависимости от сил межатомной связи теплота кристаллизации для различных металлов изменяется от 2500 Дж/моль (например, N8, К) до 20000 Дж/моль (например, IV). Когда кристаллизуется чистый элемент, отвод теплоты, происходящий вследствие охлаждения, компенсируется теплотой кристаллизации. В связи с этим на кривой охлаждения, изображаемой в координатах температура — время, процессу кристаллизации соответствует горизонтальный участок (рис. 3.2). При большом объеме жидкого металла выделяющаяся при кристаллизации теплота повышает температуру практически до равновесной (см. рис. 3.2, кривая а); при малом объеме металла выделяющейся теплоты недостаточно, вследствие чего кристаллизация происходит с переохлаждением по сравнению с равновесной температурой (см. рис. 3.2, кривая б).
Р

чистоты металла и ростом скорости охлаждения. Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30 °С; при больших скоростях охлаждения она может достигать сотен градусов. Ниже приведены значения степени переохлаждения для некоторых металлов:
Р
Ме
Ь 8п 8Ъ Аи Си Ге N1 Со Р1АТ, °С . . . 80 118 135 230 236 295 319 330 370
Степень перегрева при плавлении металлов, как правило, не превышает нескольких градусов.
В жидком состоянии атомы вещества вследствие теплового движения перемещаются беспорядочно. В то же время в жидкости имеются группировки атомов небольшого объема, в пределах которых расположение атомов вещества во многом аналогично их расположению в решетке кристалла. Эти группировки неустойчивы, они рассасываются и вновь появляются в жидкости. При переохлаждении жидкости некоторые из них (наиболее крупные) становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называют центрами кристаллизации (зародышами). Образованию зародышей способствуют флуктуации энергии, т.е. отклонения энергии группировок атомов в отдельных зонах •жидкого металла от некоторого среднего значения. Размер образовавшегося зародыша зависит от величины зоны флуктуации.
Появление центров изменяет термодинамический потенциал системы АС0бщ (рис. 3.3). С одной стороны, при переходе жидкости в кристаллическое состояние термодинамический потенциал уменьшается на VДСУ(Ст), с другой — он увеличивается вследствие появления поверхности раздела между жидкостью и кристаллическим зародышем на величину, равную 5сг(Сг):
А
(3.1)
С0бщ = — V АСу + 5 сг,где V — объем зародыша, см3; АС у — удельная разность термодинамических потенциалов при переходе жидкости в кристаллическое состояние

А
(3.2)
Су = Я А Т/Тк,5 — поверхность зародыша, см2; а — удельное поверхностное натяжение на границе кристалл — жидкость, Н/м.
Если принять, что зародыш имеет форму куба с ребром А, то общее изменение термодинамического потенциала
ЛСобщ = А3 АСу + 6 А2о. (3.3)
Из уравнения (3.3) следует, что зависимость изменения термодинамического потенциала от размера зародыша имеет максимум (см. рис. 3.3) при некотором значении А, названном критическим. Зародыши с размером больше критического вызывают уменьшение ДС0бщ и поэтому являются устойчивыми, способными к росту. Зародыши, имеющие размер меньше критического, нестабильны и растворяются в жидкости, поскольку вызывают увеличение ДС0бщ- Для определения критического значения А нужно продифференцировать АС по А и приравнять производную к нулю: ^Асг0бщ/<М = 0. Тогда
Акр = Ап/АСу. (3.4)
С увеличением степени переохлаждения поверхностное натяжение изменяется незначительно, а АСу быстро повышается, а. следовательно, критический размер зародыша убывает и появляется больше зародышей, способных к росту. В этом легко убедиться, если подсчитать критический размер зародыша, например железа, при разных степенях переохлаждения, например: А1\ = 10 К и ДТг = 100 К. Зная удельную скрытую теплоту плавления железа (Г/ = 1,5 • 103 Дж/см3 и температуру его плавления (кристаллизации) Тк — 1812 К, по формуле (3.2) определяем А Су при АТХ = 10 К: АСу = 1,5 - 103 ■ 10/1812 = 8,278 Дж/см3. Подставляя полученное значение АСу и значение а (для железа, оно равно 204 • 10-7 Дж/см2) в формулу (3.4), находим
Акр = 4 • 204 • 10~7/8,278 = 98,6 • КГ7 см = 98,6 нм.
Аналогичные расчеты, проведенные для А Гг — 100 °С, показывают, что в этом случае Акр = 9, 86 нм.
Скорость процесса и окончательный размер кристаллов при затвердевании определяются соотношением между скоростью образования центров кристаллизации и скоростью роста. Первая измеряется числом зародышей, образующихся в единицу времени в единице объема (мм-3 ■ с-1), вторая — увеличением линейного размера растущего кристалла в единицу
Р
\
Рис. 3.3. Изменение термодинамического потенциала при образовании зародышей в зависимости от их размера
 ис.
3.4. Изменение скорости образования
зародышей V,
и скорости роста кристаллов «р
в зависимости от степени переохлаждения
ДТ
ис.
3.4. Изменение скорости образования
зародышей V,
и скорости роста кристаллов «р
в зависимости от степени переохлаждения
ДТ
времени (мм/с). Оба процесса связаны с перемещениями атомов и зависят от температуры (рис. 3.4).
Для металлов, которые в обычных условиях кристаллизапии не склонны к большим переохлаждениям, как правило, характерны восходящие ветви кривых. При небольших степенях переохлаждения, когда зародыш критического размера велик, а скорость образования зародышей мала, при затвердевании формируется крупнокристаллическая структура. Небольшие степени переохлаждения достигаются при заливке жидкого металла в форму с низкой теплопроводностью (земляная, шамотовая) или в подогретую металлическую форму. Увеличение переохлаждения происходит при заливке жидкого металла в холодные металлические формы, а также при уменьшении толщины стенок отливки. Поскольку при этом скорость образования зародышей увеличивается более интенсивно, чем скорость их роста, получаются более мелкие кристаллы.
