
- •Рябухин ю.И. Общая химия Учебное пособие
- •1. Химия: определение, задачи, значение, основные понятия
- •Основные термины
- •2. Стехиометрические3 законы
- •2.1. Закон сохранения массы4
- •2.2. Закон постоянства состава
- •2.3. Закон кратных отношений
- •2.4. Закон эквивалентов
- •2.5. Закон авогадро
- •3. Периодический закон и периодическая система химических элементов д.И. Менделеева2
- •3.1. История систематизации химических элементов
- •3.2. Основная закономерность периодического закона
- •3.3. Периодическая система химических элементов: группы и периоды
- •3.4. Принцип построения периодической системы
- •3.5. Значение периодического закона и периодической системы химических элементов д.И. Менделеева
- •4. Строение атома
- •4.1. Электрон
- •4.2. Модель строения атома томсона
- •4.3. Ядерная модель строения атома резерфорда
- •Подтверждение теории Резерфорда
- •Значение теории Резерфорда
- •4.4 Уравнение шрёдингера1. Электронная конфигурация атома
- •Алгоритм написания электронных формул атомов химических элементов
- •5. Химическая связь
- •5.1. Понятие химической связи
- •5.2. Электроотрицательность
- •5.3. Природа и механизм образования ковалентной связи
- •Механизм перекрывания атомных орбиталей
- •5.4. Характерные особенности ковалентной связи
- •5.5. Валентность атомов элементов. Поляризация ковалентной связи. Дипольный момент
- •5.6. Ионная связь
- •6. Общие свойства растворов. Растворы неэлектролитов
- •6.1. Дисперсные системы
- •Классификация дисперсных систем в зависимости
- •Значение дисперсных систем
- •6.2. Молекулярные растворы
- •Сходство молекулярных растворов с химическими соединениями
- •Отличие сольватов от химических соединений
- •6.3. Концентрация растворов
- •6.4. Способы выражения концентрации растворов
- •6.5. Растворимость газов, жидкостей и твёрдых веществ
- •Факторы, влияющие на растворимость газов в жидкостях
- •Растворимость жидкостей в жидкостях
- •Растворимость твёрдых веществ в жидкостях
- •6.6. Закономерности поведения растворов: закон рауля
- •6.7. Осмос3
- •7. Растворы электролитов
- •7.1. Теория аррениуса
- •7.2. Теория каблукова
- •7.3. Электролиты и неэлектролиты. Диссоциация электролитов
- •7.4. Свойства растворов электролитов
- •7.5. Ионное произведение воды
- •7.6. Гидролиз
- •7.7. Протолитическое равновесие
- •Автопротолиз воды
- •8. Комплексные соединения
- •Примеры реакций комплексообразования
- •Практическое применение комплексных соединений
- •9. Химическая кинетика и химическое равновесие
- •9.1. Скорость химических реакций
- •9.2. Зависимость скорости химических реакций от условий их протекания
- •9.3. Обратимые химические реакции. Химическое равновесие
- •9.4. Условия смещения химического равновесия. Принцип ле шателье
- •10. Окислительно-восстановительные реакции
- •10.1. Общая характеристика
- •10.2. Основные положения теории окислительно-восстановительных реакций
- •10.3. Классификация окислительно-восстановительных реакций
- •10.4. Важнейшие восстановители и окислители
- •Важнейшие окислители и восстановители
- •10.5. Составление уравнений окислительно-восстановительных реакций.
- •Метод электронного баланса
- •Метод электронно-ионного баланса Метод полуреакции
- •Достоинства метода полуреакций:
- •10.6. Влияние среды на характер протекания окислительно-восстановительных реакций
- •Правила окислительно-восстановительных реакций при разных значениях рН среды:
- •10.7. Окислительно-восстановительный потенциал
- •10.8. Понятие электролиза.
- •10.9. Электролиз расплавов Электролиз расплава хлорида натрия
- •Электролиз расплава гидроксида калия
- •10.10. Электролиз водных растворов электролитов
- •Ряд стандартных электродных потенциалов металлов
- •Последовательность выделения металлов на катоде
- •10.11. Количественное описание электролиза. Законы фарадея
- •10.12. Применение электролиза
- •2. Растворимость кислот, оснований и солей в воде
- •3. Относительные электроотрицательности атомов элементов в периодической системе химических элементов д.И.Менделеева
Механизм перекрывания атомных орбиталей
Чтобы произошёл обмен неспаренными электронами у атомов А и В (их объединение), необходимо проникновение одной атомной орбитали (АО) в другую, т. е. их перекрывание (электронная пара становится общей для двух ядер связываемых атомов).
Но чтобы произошло такое перекрывание, необходимо сближение ядер атомов на небольшое расстояние (100-200 пм1). Чем больше перекрывание АО, тем выше электронная плотность между атомными ядрами, и тем прочнее химическая связь (АО как бы втягиваются друг в друга и центрируются в пространстве между атомными ядрами).
После перекрывания АО пара электронов принадлежит каждой из них, а в соответствии с принципом Паули на одной АО не могут находиться два электрона с противоположными значениями спинового квантового числа.
При донорно-акцепторном механизме образования ковалентной связи атом А передаёт неподелённую пару электронов на вакантную АО атома В. В этом случае происходит перекрывание АО обоих атомов и образование области повышенной электронной плотности между их ядрами.
Примеры: полимеризация неорганических соединений, гидра-тация ионов, реакции комплексообразования в растворе.
Рассмотрим присоединение фторид-иона F– к молекуле ВF3. Вакантная р-орбиталь атома бора в молекуле ВF3 акцептирует пару электронов от фторид-иона с его р-орбитали посредством перекрывания с этой АО. В образовавшемся анионе [ВF4]– все четыре ковалентные связи В–F равноценны по длине и энергии, несмотря на различие в механизме их образования. В исходной молекуле ВF3 все три связи В–F образовались по обменному механизму.
С позиций донорно-акцепторного механизма образования ковалентной связи можно объяснить наличие чётных кислородных кислот хлора: HClO (хлорноватистая), НС1О2 (хлористая), НС1О3 (хлорноватая) и НС1О4 (хлорная). В молекуле Н–О–С1 у атома хлора имеется три неподелённых пары электронов, поэтому ещё к нему могут последовательно присоединиться по донорно-акцепторному механизму три атома кислорода. Допускают, что каждый присоединяемый атом кислорода (акцептор1электронов) перед образованием связи Сl–О переходит в возбуждённое состояние и, объединяя неспаренные электроны, освобождает одну из р-орбиталей для приёма электронной пары от атома хлора (донора2 электронов):
![]()

Дативный механизм образования ковалентной связи (или dπ–рπ-взаимодействие). Атомы, внешняя электронная оболочка которых состоит только из s- и р-орбиталей, могут быть либо донорами, либо акцепторами неподелённой электронной пары. Атомы, у которых внешняя электронная оболочка включает ещё и d-орбитали, могут выступать одновременно как доноры и как акцепторы неподелённых электронных пар.
Пример. Атомы хлора в молекуле Сl2 образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, один атом хлора передаёт неподелённую пару электронов с 3р-орбитали на вакантную 3d-орбиталь другого атома хлора, а этот атом в свою очередь передаёт такую же пару 3р-электронов на вакантную 3d-орбиталь первого атома хлора. Таким образом, каждый атом хлора одновременно является и акцептором, и донором.
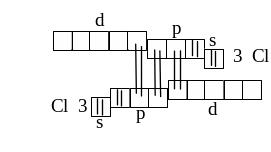
Дативный механизм приводит к увеличению прочности связи, и поэтому молекула С12 является более прочной, чем молекула F2, ковалентная связь которой образовалась только по обменному механизму. Энергии разрыва связей в молекулах F2 и С12 соответственно равны 159 и 243 кДж/моль.
