
- •I. Элементы симметрии.
- •Центр симметрии (центр инверсии),I
- •Плоскость симметрии
- •Простая ось симметрии n-го порядка Cn
- •Зеркально-поворотная ось симметрии n - ого порядка Sn.
- •П. Способы изображения пространственного строения молекул
- •1. Клиновидная проекция.
- •2.Конформации. Формулы Ньюмена.
- •Ш. Хиральность. Молекулы с одним асимметрическим атомом.
- •1. Энантиомеры. Асимметрический атом
- •2.Абсолютная конфигурация
- •3.Проекционные формулы Фишера
- •1.Принципы r,s-номенклатуры
- •2.Определение порядка старшинства сложных заместителей при асимметрическом атоме
- •V.Оптическая активность. Рацематы.
- •VI.Молекулы с двумя асимметрическими атомами. Диастереомеры.
- •VII Относительная конфигурация. Эритро-трео-обозначения.
- •VIII Методы Разделения энантиомеров.
- •Метод Пастера.
- •Расщепление через диастереомерные соли .
- •Биохимический метод.
- •IX. Стереоизомерия алкенов.
- •X. Дополнительные сведения. 1.Особенности изображения циклических молекул
- •2.Конформационная энантиомерия
- •3. Проекции Фишера и для молекул с тремя и более асимметрическими атомами.
- •Амино и гидроксикислоты
- •5.Хиральные молекулы без асимметрических атомов
- •6.К правилу последовательности в r,s - номенклатуре.
Биохимический метод.
Этот метод основан на высокой избирательности работы ферментов. Ферменты, имеющиеся в живых организмах, способны катализировать превращения стереоизомера лишь с одной, вполне определенной конфигурацией хирального центра. Рассмотрим использование этого метода для разделения рацемата аминокислоты метионина. Вначале на рацемат действуют ацетилирующим реагентом (вводят ацетильную группу). При этом получают рацемат, состоящий из N-ацетильных производных (+) и (-)-метинина. Затем ацетильные производные подвергают ферментативному гидролизу в присутствии фермента ацилазы. Производное(+)- метионина гидролизуется в 1000 раз медленнее, чем производное (-) - метионина.

Таким образом, рацемат метионина превращается в смесь N-ацетильного производного (+)-метионина и свободного (-)-метионина. Эту смесь легко разделить. Так, свободный метионин растворяется в воде и в разбавленных кислотах, в то время как N-ацетильное производное - не растворяется. Помимо приведенных здесь методов разделения энантиомеров, в настоящее время в арсенале химиков имеются и другие, о которых можно прочитать в специальной литературе.
IX. Стереоизомерия алкенов.
Атомы углерода молекулы этилена находятся в sp2-гибридном состоянии:

Двойную связь С -С можно
рассматривать как состоящую из
-связи
(перекрывание гибридных орбиталей
атомов углерода) и ![]() -связи,
образованной боковым перекрыванием
р-орбиталей:
-связи,
образованной боковым перекрыванием
р-орбиталей:
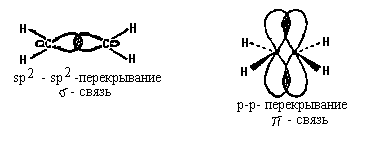
Поворот CН2-гpynn молекулы этилена друг относительно друга должен привести к нарушению перекрывания р-орбиталей, то-есть к разрыву -связи. Энергетический барьер такого поворота по разным оценкам, составляет 60-65 ккал/ моль и при обычных условиях такой поворот не происходит (поворот возможен при фотохимическом возбуждении молекулы) Сказанное в полной мере относится и к другим молекулам с двойной связью С=С. Поэтому для алкенов возможна стереоизомерия, обусловленная различным взаимным расположением заместителей при двойной связи:

Стереоиозмеры (22) и (23) не являются зеркальными антиподами. Согласно определению, приведенному на стр. 42, изомеры (22) и (23) - это диастереомеры. Иногда, с целью подчеркнуть причастность -связи к появлению этой изомерии, их называют -диастереоизомерами (раньше их называли геометрическими изомерами) в отличие от -диастереомеров, рассмотренных в разделе VI.
Конечно, этот вид изомерии невозможен, если хотя 6ы у одного из атомов углерода, образующих двойную связь, два заместителя одинаковы:
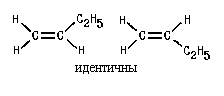
Для наименования -диастереомеров широко используется цис-транс-номенклатура. Ее применяют в тех случаях, когда у разных атомов углерода С = С-связи есть одинаковые заместители.
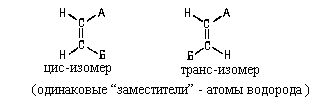
В сооветствии с этим, изомеры (22) и (23) следует назвать цис-бутен-2 и транс-бутен-2. Аналогично можно назвать приведенные ниже соединения.
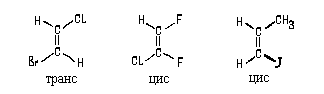
Но что делать, если все четыре заместителя при двойной связи - разные? Какой, например, изомер изображен ниже: цис- или транс-?

В таком случае надо выбрать старший заместитель при одном атоме углерода, образующем двойную связь, и старший заместитель при другом атоме углерода. Сравнивая положение старших заместителей относительно двойной связи, можно приписать изомеру ту или иную конфигурацию. На этом основана E,Z -номенклатура -диастереомеров.
Старшинство заместителей определяется точно так же, как и при наименовании конфигурации асимметрического атома по Kaну - Ингольду -Прелогу. Старшим считается тот атом, который имеет больший номер в Периодической таблице Д.И.Менделеева (в случае сложных заместителей при двойной связи поступают так же, как это описано в разделе IV.2).
Если старшие заместители находятся по одну сторону относительно двойной связи, изомеру приписывают Z-конфигурацию (от немецкого "zusammen" - вместе)
Если старшие заместители расположены по разные стороны двойной связи, изомеру приписывают Е-конфигурацию (от немецкого "entgegen" - напротив):

Аналогично, цис-бутен-2 получает название: Z -бутен-2, а транс-бутен-2 будет называться: Е-бутен-2.
Следует иметь в виду, что когда говорят о Е- или Z- конфигурации, подразумевают относительную конфигурацию, поскольку при этом рассматривается взаимное расположеннозаместителей при двух атомах углерода в молекулах диастереомеров.
