
- •Методические указания для самостоятельной работы студентов по Учебной дисциплине «Химия, часть 2 - Физическая и коллоидная химия»
- •1. Общая программа дисциплины
- •1.1. Назначение дисциплины
- •1.2. Темы лекционных занятий
- •1.3. Лабораторный практикум
- •1.4. Темы домашних заданий
- •2. Разминка! Примеры решения задач по теме «овр» Пример 1. Составить электронную схему и закончить уравнение реакции:
- •Пример 2.
- •Пример 3.
- •Пример 4.
- •В щелочной среде в качестве продуктов реакции можно образовать он-, либо н2о.
- •2.1. Написать в молекулярной и ионно-молекулярной формах уравнения реакций
- •2.2. Закончить и уравнять окислительно-восстановительную реакцию методом полу-реакций
- •2.3. Составить молекулярное и ионное уравнения гидролиза соли для обычных условий
- •2.4. Решить задачу с использованием расчетов по уравнению реакции
- •2.5. Решить задачу с использованием расчетов по уравнению реакции
- •3. Основы химической термодинамики
- •3.1. Краткие теоретические сведения
- •3.2. Примеры решения задач
- •Пример 6. Определить теплоту, работу, изменение внутренней энергии и конечное давление при изохорном нагревании 57,3 г оксида углерода (II) от 25 до 100°с при исходном давлении 1 атм.
- •Пример 7. Определить теплоту, работу, изменение внутренней энергии и конечное давление при изотермическом расширении 60 г оксида углерода (IV) от 0,05 до 0,1 м3 при исходном давлении 1 атм.
- •Пример 8. Вычислить тепловой эффект и изменение энергии Гиббса реакции протекающей в водном растворе, при 298 k:
- •Пример 9. Вычислить изменение энергии Гиббса реакции при 298 k.
- •Пример 10. Вычислить изменение энергии Гиббса реакции при 850 k.
- •Пример 11. Вычислить количество теплоты и объем пропана (н.У.), необходимые для нагревания 1 кг кварца от 25 до 800 °с (тепловой эффект горения пропана учитывать как для 25 °с).
- •3.3. Задачи для решения
- •3.3.1 Расчеты с применением первого начала термодинамики
- •3.3.2. Вычислить тепловой эффект и энергию Гиббса при 298 k для реакции в водном растворе
- •3.3.3. Вычислить энергию Гиббса реакции при заданной температуре
- •4. Расчет термодинамических параметров химических реакций
- •4.1. Краткие теоретические сведения
- •4.2. Примеры решения задач Пример 12. Вычислить тепловой эффект и изменение энергии Гиббса реакции
- •Пример 13. Вычислить изменение энергии Гиббса реакции
- •Пример 14. Вычислить изменение энергии Гиббса при 850 k для реакции
- •5. Расчет константы равновесия при заданной температуре
- •5.1. Краткие теоретические сведения
- •5.2. Примеры решения задач
- •5.2.1. Метод Темкина-Шварцмана
- •5.2.2. Метод приведенных энергий Гиббса
- •5.3. Задачи для решения
- •Пример 18. Вычислить состав равновесной смеси, образующейся при протекании реакции
- •6.3. Задачи для решения
- •6.3.1. Задачи на расчет степени превращения вещества
- •6.3.2. Задачи на расчет равновесного состава газовой смеси
- •7. Двухкомпонентные диаграммы состояния жидкость-газ
- •7.1. Краткие теоретические сведения
- •7.1.1. Общая информация
- •7.1.2. Типовые диаграммы состояния
- •7.1.3. Порядок рассмотрения диаграммы
- •7.3. Задачи для решения
- •7.3.1. Расшифровать диаграмму состояния «жидкость-газ» по примеру 19(7.2, стр.36).
Пример 3.
1. Окислителем является марганец (VII) в составе перманганат-иона . В кислой среде перманганат-ион восстанавливается до катиона марганца (II) – Mn2+. Восстановителем является сера (IV) в составе сульфит-иона , которая окислится до серы (VI) в составе сульфат-иона .
2. Составляют полу-реакцию восстановления марганца
2.1. Записывают исходный ион, продукт реакции и электроны, принимающие участие в реакции

2.2. Из кислорода в составе перманганат-иона образуют воду и уравнивают кислород перманганат-иона и гидроксил-иона

2.3. В кислой среде водород берут в виде катиона Н+ и уравнивают полу-реакцию

3. Составляют полу-реакцию восстановления сульфит-иона
3.1. Записывают исходный ион, продукт реакции и электроны, принимающие участие в реакции
3.2. Кислород для баланса берут от молекулы воды; «лишние» атомы водорода образуют катионы водорода:
Примечание: в кислой среде в качестве продуктов реакции можно образовать H+, либо Н2О.
4. Суммируют полу-реакции с учетом баланса электронов

и получают сокращенное ионное уравнение.
5. Составляют молекулярное уравнение реакции
 .
.
Пример 4.
1. Окислителем
является марганец (VII)
в составе перманганат-иона
,
который в щелочной среде восстанавливается
манганат-иона
 .
Восстановителем является сера (IV)
в составе сульфит-иона
,
которая окислится до серы (VI)
в составе сульфат-иона
.
.
Восстановителем является сера (IV)
в составе сульфит-иона
,
которая окислится до серы (VI)
в составе сульфат-иона
.
2. Составляют полу-реакцию восстановления марганца

3. Составляют полу-реакцию восстановления сульфит-иона
3.1. Записывают исходный ион, продукт реакции и электроны, принимающие участие в реакции
3.2. Кислород для баланса берут от гидроксил-иона; атомы водорода образуют воду:
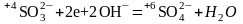
В щелочной среде в качестве продуктов реакции можно образовать он-, либо н2о.
4. Суммируют полу-реакции с учетом баланса электронов

и получают сокращенное ионное уравнение.
5. Составляют молекулярное уравнение реакции
 .
.
2.1. Написать в молекулярной и ионно-молекулярной формах уравнения реакций
|
|
