
- •Лекція № 10 Фізико-хімія колоїдних систем
- •Загальні відомості про колоїдні системи
- •2. Одержання колоїдних систем
- •Методи диспергування
- •Хімічна конденсація
- •3. Будова колоїдних розчинів
- •4. Методи очищення колоїдних розчинів
- •5. Властивості золів
- •5.1. Молекулярно кінетичні властивості колоїдних розчинів
- •5.2. Оптичні властивості колоїдних розчинів
- •Поглинання світла та колір золів
- •Оптичні методи дослідження колоїдних розчинів
- •5.3. Електрокінетичні явища
- •5.3.2. Шляхи утворення та будова пеш
- •Шляхи утворення пеш
- •Будова подвійного електричного шару
Хімічна конденсація
У цих випадках дисперсна фаза утворюється в результаті хімічної реакції. Щоб у ході реакції утворився сам колоїдний, а не істинний розчин або осад, необхідне дотримуватися трьох умов:
1) щоб речовина дисперсної фази була нерозчинною в дисперсійному середовищі;
2) щоб швидкість утворення зародків кристалів дисперсної фази була набагато більше, ніж швидкість росту кристалів; ця умова виконується звичайно тоді, коли концентрований розчин одного компонента вливається в сильно розведений розчин іншого компонента при інтенсивному перемішуванні;
3) щоб одна з вихідних речовин була взята в надлишку, саме вона є стабілізатором.
Методи хімічної конденсації різноманітні – практично будь-яка хімічна реакція, що приводить до утворення нової фази, може служити способом одержання колоїдного розчину. Наведемо кілька прикладів:
1. Реакція відновлення:
Ag2О + Н2 → 2Ag↓ + Н2О.
золь
Цю реакцію проводять у присутності стабілізатора (танін, крохмаль, желатин).
2. Реакція окиснення:
2H2S + SO2 → 3S↓ + 2H2O.
золь
3. Реакція гідролізу:
FеС13+3Н2О → Fе(OH)3↓ + 3НС1.
золь
4. Реакція обміну:
K4[Fe(CN)6] + 2CuCl2 → Cu2[Fe(CN)6]↓ + 4KC1.
золь
Окрема треба розглянути процес пептизації. Пептизація – процес переходу осадів, які утворились при коагуляції у колоїдний стан. Вона відбувається під дією розчинів певних речовин (пептизаторів), у складі яких є стабілізатор. На відміну від інших методів одержання золів, при пептизації не відбувається зміни ступені дисперсності, а спостерігається лише роз’єднання частин.
У процесі промивання з осаду вимиваються йони, які сприяють коагуляції, а колоїдні частини адсорбуються на поверхні пептизатора. Сили відштовхування починають переважати над силами тяжіння. Утворені колоїдні частини поступово, під впливом броуновського руху починають переходити у розчин.
Пептизувати можна далеко не всі осади; щільні, важкі осади не піддаються пептизації, навпаки, пухкі (сажа, графіт, глина), драглисті осади, особливо свіжі, легко пептизуються.
Формально пептизацію можна віднести до методів диспергування, але це неправильно. Осад, що пептизується – вже диспергирований матеріал, доведений до колоїдного ступеня подрібнення, у якому частки в результаті злипання утворили великі агрегати. Пептизація – це порушення зв’язків між злиплими частками. Чим більш слабкі ці зв’язки, тим легше відбувається пептизація.
3. Будова колоїдних розчинів
Одержати колоїдні розчини можна за допомогою реакцій обміну, розкладу, окисно-відновних, гідролізу та ін.
Структурною одиницею дисперсної фази є міцела, дисперсійне середовище інакше зветься інтерміцелярною рідиною.
Розглянемо утворення золю AgІ у надлишку АgNO3 реакцією обміну.
Запишемо реакцію утворення осаду AgІ.
AgNO3 + KІ AgІ + KNO3.
Велика кількість молекул (m) нерозчинного аргентум йодиду утворюють ядро міцели. На цьому ядрі адсорбуються qони з розчину, які є у надлишку і входять до складу ядра, у даному випадку nAg+. Вони звуться потенціал-визначальними йонами, тому що визначають заряд колоїдної частини та гранули. Далі до шару потенціал-визначальних іонів приєднується деяка кількість іонів протилежного знаку (протийони), які у надлишку знаходяться у розчині. У даному випадку – це йони NO3–. Весь утворений комплекс зветься колоїдною частинкою, має певний заряд і до його складу входить адсорбційний шар протийонів. Остання кількість протийонів утворює дифузійний шар і у цілому утворюється електронейтральна частина – міцела ‒ {[ mAgІ] nAg+ (n - x) NO3–} xNO3–.

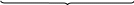
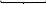
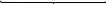
{[ mAgІ] nAg+ (n - x) NO3–} xNO3–.
 ядро
ядро
гранула
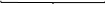 колоїдна
частинка
колоїдна
частинка
міцела
 дифузійний
шар
дифузійний
шар
{[ mAgІ] nAg+ (n - x) NO3–} xNO3–.
адсорбційний шар
Розглянемо утворення міцел при взаємодії аргентум нітрату з надлишком калій йодиду. Ядро mAgІ; потенціал-визначальні йони – nІ‒, адсорбційний шар протийонів – (n -x) K+, дифузійний шар протиіонів - х K +.
{[mAgІ] nІ– (n - x)K+}xK+.
У першому випадку гранула має позитивний заряд, у другому негативний. Отже, заряд гранули залежить від умов добування золів. Стабілізаторами у цих системах є електроліти, у складі яких є потенціал-визначальні йони (тобто ті, які присутні у надлишку). В цьому випадку ці йони називають стабілізуючими йонами. У першому випадку стабілізуючи йони йони аргентуму, у другому йони йодиду.
Далі наведені приклади утворення золів у других типах реакцій.
Утворення золю ферум гідроксиду при гідролізі FeCl3:
{[m Fe(OH)3] n Fe(OH)2+·2(n - x) Cl–} 2xCl–.
стабілізуючи йони – продукти гідролізу FeCl3;
в окисно–відновних реакціях, наприклад, утворення золю сульфуру:
2H2S + O2 S + 2H2O,
{[mS] nHS– (n-x)H+} xH+ ;
стабілізуючи йони – аніони сульфідної кислоти:
у реакціях розкладу: H2S2O3 H2O + SO2 + S,
{[mS] nHS2O3- (n-x)H+}xH+.
