
- •Лекція № 9 Фізико-хімія поверхених явищ. Адсорбція
- •1. Загальні уявлення про поверхневі явища в дисперсних системах
- •2. Поняття про поверхневий натяг
- •3.Загальні уявлення про адсорбцію
- •Класифікація адсорбційних процесів
- •Термодинаміка адсорбції
- •4.Адсорбція з розчинів на міжфазній поверхні рідина – газ або рідина − рідина
- •5. Теорія мономолекулярної адсорбції Ленгмюра
- •6. Адсорбція на твердих тілах
- •6А. Адсорбція газів на твердих поверхнях. Рівняння Фрейндліха
- •6Б.Адсорбція розчиненої в рідині речовини на твердому сорбенті
- •6Б.1. Молекулярна адсорбція з розчинів
- •6Б.2. Іонна адсорбція з розчинів
6Б.Адсорбція розчиненої в рідині речовини на твердому сорбенті
Явище адсорбції з рідких розчинів на твердих сорбентах різноманітні й класифікуються в залежності від природи адсобата: молекулярна та йонна адсорбція.
6Б.1. Молекулярна адсорбція з розчинів
Молекулярна адсорбція відбувається з розчинів неелектролітів або слабких електролітів. Особливість процесу полягає в тому, що разом з молекулами розчиненої речовини абсорбуються й молекули розчинника.
Експериментально адсорбцію визначають вимірюючи концентрації розчиненої речовини до і після процесу адсорбції:
Г
=
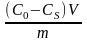 моль/г,
моль/г,
де Г – кількість адсорбованої речовини, яка приходиться на1 г сорбента, m – маса адсорбента, V – об’єм розчина, з якого відбувається адсорбція.
Залежність адсорбції від концентрації сорбата можна описувати рівняннями Гіббса, Ленгмюра, Фрейндліха та БЕТ.
Для молекулярної адсорбції характерні такі закономірності.
Перша полягає у тому, що ефективність адсорбенту за конкретних умов визначається його полярністю. Академік П. Ребіндер сформулював правило вирівнювання полярності: процес адсорбції від-бувається у бік вирівнювання полярностей фаз, причому, чим більша різниця полярностей, ттим швидше відбувається цей процес. Мірою полярності речовини є її діелектрична проникність ε (відношення, яке показує в скільки разів сила взаємодії двох одиничних зарядів у вакуумі більше, ніж в даному середовищі).
 Явище
адсорбції ПАР на межі рідина ‒ газ
відбувається на межі поділу розчин ПАР
‒ тверде тіло. Особливість цього процесу
полягає в орієнтації адсорбційного
шару молекул ПАР, яка відбувається за
правилом вирівнювання полярностей
Ребіндера. Пояснимо це правило за
допомогою рис. 12.
Явище
адсорбції ПАР на межі рідина ‒ газ
відбувається на межі поділу розчин ПАР
‒ тверде тіло. Особливість цього процесу
полягає в орієнтації адсорбційного
шару молекул ПАР, яка відбувається за
правилом вирівнювання полярностей
Ребіндера. Пояснимо це правило за
допомогою рис. 12.
Рис. 12. Ориієнтація молекул ПАР на межі поділу фаз: вугілля‒вода (а) та силікагель‒бензен (б)
На межі поділу неполярного твердого тіла, наприклад, активованого вугілля (ε = 1) з полярною рідиною ‒ водою (ε = 81), адсорбційний шар розчиненої ПАР (ацетатної кислоти ε = 6, аніліну ε = 7, бутанолу ε = 18 тощо) буде орієнтований гідрофільною частиною у бік рідини (рис, 12. а).
Таким чином, неполярний адсорбент покривається полярною частиною адсорбційного шару. Відбувається зміна полярностей фаз: з неполярно-полярної межа поділу стає полярно-полярною.
Вирівнювання полярностей фаз відбувається і на межі поділу полярної поверхні (глини, силікагелю, крейди) з розчином ПАР у неполярній рідині, зокрема бензені (рис. 12, б). У цьому випадку межа поділу фаз між полярним твердим тілом і бензеном замінюється на межу між неполярним адсорбційним шаром на твердому тілі та неполярною рідиною.
Отже, за допомогою ПАР можна регулювати орієнтацію адсорбційного шару і змінювати властивості поверхні поділу фаз.
Друга закономірність пов’язана з виконанням правила Дюкло -Траубе при адсорбції з розчинів. Адсорбція представників гомологічного ряду ПАР на гідрофобних адсорбентах з водних розчинів збільшується зі зростанням довжини їх вуглеводневої групи: НСООН < СН3СООН < С2Н5СООН < С3Н7COOH < С JLCOOH. Наприклад, у ферментному процесі гідролізу пептонів пепсином, продукти реакції мають меншу поверхневу активність, ніж вихідні речовини, тому вони заміщуються на поверхні ферменту все новими і новими макромолекулами субстрату.
Але якщо розглядати адсорбцію окремих представників гомологічного ряду ПАР на гідрофільних адсорбентах з неполярних розчинників, то підвищення розчинності ПАР у цих розчинниках зі збільшенням молекулярної маси дає результати, обернені правилу Дюкло - Траубе: збільшення ланцюга на одну групу СН2 призводить до зниження адсорбції ПАР.
Висновки:
1. Полярні адсорбати краще адсорбуються на полярних адсорбентах з неполярних розчинників.
2. Неполярні адсорбати краще адсорбуються на неполярних адсорбентах із полярних розчинників.
3. Чим більша розчинність речовинну даному розчиннику, тим гірше вона адсорбується з розчину.
Адсорбцію, зокрема молекулярну, широко застосовують у медицині. Починаючи з 80-х років XX століття, у медичній практиці почали широко використовувати ентеросорбенти та іммобілізовані препарати, тобто ферменти, гормони, антибіотики, закріплені на неорганічних та органічних полімерах. Такими полімерами є похідні акрилових кислот, вінілового спирту, вінілпіролідону, силікагель тощо.
Іммобілізацію біологічно-активних та лікарських препаратів проводять як фізичними, так і хімічними методами. Одним із перших був застосований фізичний метод, а саме адсорбція різних біологічно-активних препаратів на активованому вугіллі.
Іммобілізовані біопрепарати використовують у медичній практиці для діагностики та лікування багатьох захворювань.
