
- •Лекція № 9 Фізико-хімія поверхених явищ. Адсорбція
- •1. Загальні уявлення про поверхневі явища в дисперсних системах
- •2. Поняття про поверхневий натяг
- •3.Загальні уявлення про адсорбцію
- •Класифікація адсорбційних процесів
- •Термодинаміка адсорбції
- •4.Адсорбція з розчинів на міжфазній поверхні рідина – газ або рідина − рідина
- •5. Теорія мономолекулярної адсорбції Ленгмюра
- •6. Адсорбція на твердих тілах
- •6А. Адсорбція газів на твердих поверхнях. Рівняння Фрейндліха
- •6Б.Адсорбція розчиненої в рідині речовини на твердому сорбенті
- •6Б.1. Молекулярна адсорбція з розчинів
- •6Б.2. Іонна адсорбція з розчинів
5. Теорія мономолекулярної адсорбції Ленгмюра
На основі молекулярно-кінетичної теорії Ленгмюром було виведене рівняння:
Г
= Г
 ,
,
де Г – максимальна адсорбція речовини; Г – адсорбція при концентрації С; K – константа адсорбційної рівноваги.
На кривій залежності адсорбції від концентрації чітко видні три ділянки: ділянка I – пряма лінія, що виходить з початку координат. Дійсно, з рівняння Ленгмюра при малих концентраціях KС<<1, і Г = ГKC; ділянка III – відповідає прямій, паралельній осі абсцис, що означає, що адсорбція досягла свого граничного значення, KС >>1 і Г = Г. Ділянка II відповідає криволінійній частини графіка й описується повним рівнянням Ленгмюра.
Щоб знайти Г і K в рівнянні Ленгмюра, його треба привести до лінійної форми. Для цього беруть зворотні значення правої і лівої частин рівняння й помножують на величину С:
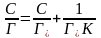
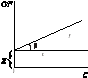

Рис. 6. Залежність адсорбції від концентрації ПАР
Рис. 7. Лінійний графік рівняння Ленгмюра
Тангенс
кута
нахилу
прямої
до осі абсцис дає значення
 ,
а відрізок Z,
що відрізається
прямою
на осі ординат – величину
,
а відрізок Z,
що відрізається
прямою
на осі ординат – величину
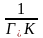 .
Побудувавши
графік
.
Побудувавши
графік
 = f(С),
можна знайти граничну
або
максимальну
адсорбцію
(граничну
ємність адсорбента)
Г
та константу рівноваги K.
= f(С),
можна знайти граничну
або
максимальну
адсорбцію
(граничну
ємність адсорбента)
Г
та константу рівноваги K.
Фізичний
зміст константи K.
Якщо величина адсорбції складає половину
максимальної адсорбції маємо:
Г = 0,5
Г;
0,5 Г
= Г ;
0,5(K
+ C)
= C;
K
= C,
тобто, ця константа дорівнює концентрації
адсорбованої речовини, коли адсорбція
досягає половини максимальної (граничної)
адосорбції.
;
0,5(K
+ C)
= C;
K
= C,
тобто, ця константа дорівнює концентрації
адсорбованої речовини, коли адсорбція
досягає половини максимальної (граничної)
адосорбції.
Виходячи з величини граничної адсорбції знаходять товщину адсорбційного шару (довжину молекул ПАР) і площу, що займає адсорбована молекула.
Площу знаходять за рівнянням S = (ГN)−1, де N − число Авогадро.
Товщину адсорбованого шару визначають за формулою
= ГM−1,
де M − молярна маса ПАР, − його густина.
Ленгмюр вивів рівняння для випадку адсорбції на поверхні рідини, але його можна використовувати в усіх випадках мономолекулярної адсорбції. При адсорбції газів замість рівноважних концентрацій використовують рівноважні тиски.
В 1908 році київський вчений Шишковський емпіричним шляхом установив, що константа K збільшується в 3-3,5 рази при подовженні ланцюга вуглеводневого радікалу на одну групу –СН2 і розрахував величину роботи адсорбції при збільшенні ланцюга на одну таку ланку. Вона виявилася рівної 3,2 кДж/моль. Таким чином, суть правила Дюкло-Траубе заключається в тому, що робота адсобції на кожну СН2-групу є сталою й близькою до 3,5 кДж/моль.
Розташування молекул ПАР у поверхневому шарі енергетичне найбільш вигідне при умові занурення полярних груп (–ОН, –СООН, –NН2) у воду, а вуглецевих ланцюгів ‒ у неполярну фазу. При малій концентрації адсорбованих молекул молекули в основному лежать у поверхневому шарі (рис. 8, а). При підвищенні концентрації підсилюється взаємодія вуглецевих ланцюгів, що сприяє їх орієнтації (рис. 8, б), а при повному насиченні адсорбційного шару утворюється мономолекулярний шар орієнтованих молекул (рис. 8, в).
Р ис.
8. Схема орієнтації молекул в поверхневому
шарі
ис.
8. Схема орієнтації молекул в поверхневому
шарі
Ці уявлення погоджуються з обчисленою товщиною насиченого адсорбційного шару, виходячи з максимальної адсорбції. Таким чином, при насиченні поверхневого шару на поверхні утворюється суцільний "молекулярний килим" (частокіл Ленгмюра) з молекул адсорбованої речовини. Товщина його мізерна, проте достатня, наприклад, для того, щоб помітним чином уповільнювати випаровування води.
Такі плівки утворюють практично нерозчинні у розчиннику речовини. Для води нерозчинними є гомологи органічних сполук з великим числом атомів карбону в неполярних групах (наприклад, n > 12 для одноосновних жирних кислот).
Для білкових мономолекулярних шарів товщина дорівнює ~ 10‒9 м. Мономолекулярні шари білків використовують для вивчення перебігу ферментних реакцій, проникності мембран тощо.
