
- •1 Әдеби шолу
- •1.1 Каталитикалық риформинг процесінің теориялық негіздері
- •1.2 Каталитикалық риформинг процесінің термодинамикасы
- •1.3 Каталитикалық риформинг шикізаты
- •1.4 Каталитикалық крекинг процесінің негізгі факторларының әсері
- •3 Дайын өнім, шикізат, материал, жартыфабрикаттың физика-химиялық құрамы
- •3.2 Процесстің физика-химиялық көрсеткіші. Қабылданған әдістің теориялық негізі
- •3.1 Өндірістің технологиялық схемасы
- •5.1 Каталитикалық риформингтің материалды балансы
- •5.2 Жылу балансы
- •6.Еңбекті қорғау
- •6.1 Ауаның ластануы, өрт және жарылыс қауіпі бар өндіріс туралы мәлімет
- •6.2 Өндірісте еңбектің қауіпсіздігін арттыру шаралары
- •6.3 Қоршаған ортаны ластайтын ароматты көмірсутектер көздері
- •Әдеб. Бет Беттер
5.1 Каталитикалық риформингтің материалды балансы
w*G/100 = т/жыл
w - масса шығымы, %
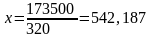 G –
өнімділік, т/жыл
G –
өнімділік, т/жыл
т/жыл
: 320 = т/тәулік
т/тәулік : 24*1000 = кг/сағ
Изопентан:
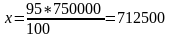 т/жыл
т/жыл
 т/тәулік
т/тәулік
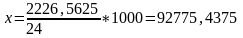 кг/сағ
кг/сағ
КС газы:
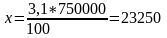 т/жыл
т/жыл
 т/тәулі
т/тәулі
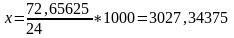 кг/сағ
кг/сағ
Шығындар:
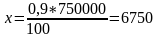 т/жыл
т/жыл
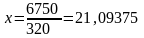 т/тәулік
т/тәулік
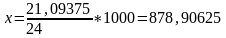 кг/сағ
кг/сағ
Жеңіл бензин фракциясының мөлшері:
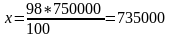 т/жыл
т/жыл
 т/тәулік
т/тәулік
 кг/сағ
кг/сағ
Сутек мөлшері:
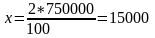 т/жыл
т/жыл
 т/тәулік
т/тәулік
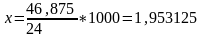 кг/сағ
кг/сағ
5.2 Жылу балансы
Бірінші реактордың жылу балансы.
Риформингтің негізгі реакциялары 1 және 2 жылуды сіңірумен жүреді, реакторлардағы температуралардың ауытқуы шикізаттың топтық көмірсутектік құрамына және реакция температурасына тәуелді болады. Бірінші реактордағы температураның ауытқуы 35 – 80К, екінші реакторда 8 – 40К, ал үшінші реакторда 0 – 17К болуы мүмкін.
Реактордың жылу балансының жалпы түрдегі теңдеуі
Q1 = Q2 + Q3 + Q4 (28)
мұндағы Q1 – шикізатпен және циркуляциялық газбен келетін жылу, кВт;
Q2 – риформинг реакциясындағы жылу шығыны, кВт;
Q3 – реакция өнімдерімен және циркуляциялық газбен кететін
жылу шығыны, кВт;
Q4 – жылудың қоршаған ортаға жоғалулары, кВт.
Аппаратқа кірер жердегі газ ағынының энтальпиясын есептейміз. Алдын ала орындалған есептеу қысымның өте жоғары болмауынан және сутекпен жеткілікті сұйылтуынан энтольпия шамасын қысымға түзету қажет емес екенін көрсетеді. Мольдік үлеспен берілген ағынның құрамын массалық үлеске есептейміз. Температура Ткіру = 803К кезіндегі сутек, метан, этан, пропан, бутан және пентан үшін энтальпия мәндерін анықтамалық әдебиеттерден табуға болады. Шикізаттың ароматты CnH2n-6, нафтенді CnH2n және парафинді CnH2n+2 көмірсутектері үшін энтальпияның сандық мәндерін кестеден алуға болады, бірақ көмірсутектердің 288К кезіндегі салыстырмалы тығыздықтарын олардың белгілі молекулалық массалары бойынша есептеу қажет болады. Көмірсутектердің табылған салыстырмалы тығыздықтарының мәндері кестеде 23 берілген.
Кесте 4 – Көмірсутектердің салыстырмалы тығыздықтары
Көмірсутектер |
Салыстырмалы тығыздықт ρ288 |
|
|
Реакторға кірерде |
Реактордан шығарда |
Ароматты |
0,718 |
0,722 |
Нафтенді |
0,731 |
0,733 |
Парафинді |
0,733 |
0,737 |
Қоректендіретін қоспаның энтальриясының есептеулерін кестеде 24 берілген.
Кесте 5 – Қоректендіретін қоспаның энтальпиясы
Компонент тер |
Молеку лалық масса Mi |
Мөлшері,ni, кмоль/сағ |
Мөлшері уi=ni/ni, мол. үлестер |
Mi уi |
Мөлшері уi=Miуi/Мсм, масс. үлестер |
Энтальпия, кДж/кг |
||
qгТi |
qгTiyi |
|||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Н2 |
2 |
11840,0 |
0,7820 |
1,56 |
0,0999 |
7700 |
769,0 |
|
СH4 |
16 |
551,0 |
0,0363 |
0,58 |
0,0371 |
1618 |
59,9 |
|
C2H6 |
30 |
668,0 |
0,0454 |
1,36 |
0,0870 |
1434 |
124,8 |
|
C3H8 |
44 |
415,6 |
0,0274 |
1,21 |
0,0770 |
1405 |
108,2 |
|
C4H10 |
58 |
137,7 |
0,0091 |
0,53 |
0,0337 |
1400 |
47,2 |
|
C5H12 |
72 |
137,7 |
0,0091 |
0,66 |
0,0418 |
1392 |
58,2 |
|
CnH2n-6 |
101,8 |
174,8 |
0,0114 |
1,16 |
0,0742 |
1713 |
127,0
|
|
Кесте 8 жалғасы |
|
|
|
|
|
|
||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
CnH2n |
107,8 |
526,0 |
0,0247 |
3,74 |
0,2387 |
1704 |
407,5 |
|
CnH2n+2 |
109,8 |
676,2 |
0,0446 |
4,88 |
0,3106 |
1703 |
528,8 |
|
Қосынды |
- |
15147,0 |
1,0000 |
15,68 15,7 |
1,0000 |
- |
2230,6 |
|
Реакцияның жылу эффектісін Гесс заңын қолданып есептеу мүмкін емес, себебі шикізат пен реакция өнімдерінің химиялық құрамдары толық айқын емес. Сондықтан келесі теңдеу қолданылады
qp = – 335 · b (29)
мұндағы b – алғашқы шикізатқа есептегендегі сутегінің шығуы, масс %.
Реактордың материалдық балансынан риформинг нәтижесінде сутек келесі мөлшерде алынатынын көруге болады
GH2 = 12943,7 – 11840 = 1103,7 кмоль/сағ.
Немесе
Gн2 = 1103,7 · Мн2 = 1103,7 · 2 = 2207,4 кг/сағ.
Q3 тең болады
Q3 = 239500qг Тшығу1 (30)
Реактордың жылу балансынан аламыз және кестеге 25 еңгіземіз
Q3 = Q1 – Q2 – Q4 (31)
Q3 = 148,3 · 103 – 20,5 ·103 – 1,48 ·103 = 126,3 ·103 кВт
Сонда
qгТшығ1
=
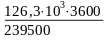 =
1900 кДж/кг
=
1900 кДж/кг
Жылу мөлшерлерні кестеге 25 еңгіземіз
Кесте 6 – Жылу мөлшері
Ағындар |
Температура, К |
Мөлшері, кг/сағ |
Энтальпия, кДж/кг |
Жылу мөлшері,кВт |
Q1 |
Ткіру = 803 |
239500 |
2230,6 |
148,3 . 103 |
Қосынды |
- |
239500 |
- |
148,3 . 103 |
Шығын |
|
|
|
|
Q2 |
- |
- |
493,2 |
20,5 . 103 |
Q3 |
724 |
239500 |
1900 |
126,3 . 103 |
Q4 |
|
|
- |
1,48 . 103 |
Қосынды |
- |
239500 |
- |
148,3 . 103 |
Реактордан кететін ағынның температурасын анықтау үшін реактордан шығатын қоспаның құрамын есептеу қажет және qгТкіру1 = f(Ткіру1) тәуелділігін көрсететін қосымша график салу қажет.
Реактордан кететін газ құрамы кесте 25 мәліметтеріне сәйкес есептелген және кестеде 26 берілген.
Кесте 7 – Реактордан кететін газ құрамы
Компо ненттер |
Молекулалық масса Mi |
Мөлшері ni, кмоль/сағ |
Мөлшеріуi=ni/ni, мольд. үлестер |
Mi уi |
Мөлшеріуi=Miуi/Мсм, масс. |
Н2 СН 4 С2Н6 С3Н8 С4Н10 С5Н12 СnH2n-6 CnH2n CnH2n+2 Қосынды |
2 16 30 44 58 72 103.3 109.3 111.3 --- |
12943.7 598.9 735.9 463.5 185.6 185.6 602.8 64.1 616.8 16396.9 |
0.7893 0.0366 0.0499 0.0283 0.0113 0.0113 0.0368 0.0039 0.0376 1.0000 |
1.58 0.58 1.35 1.25 0.65 0.81 3.80 0.43 4.19 14.64=14.6 |
0.1079 0.0400 0.0921 0.0851 0.0447 0.0556 0.2585 0.0304 0.2857 1.0000 |
qгТвых1 = f(Твых1) тәуелділігінің қосымша графигін салу үшін температураның екі болжамды сандық мәндерін 713К және 743К қабылдаймыз. Осы температуралар кезіндегі энтальпиялар мәндері есептеліп кестеге 27 еңгізілген.
Кесте 8 – Энтальпиялар мәндері
Компо ненттер |
Мөлшері уi, масс.үлес тер |
Энтальпия, кДж/кг
|
|||
713 К |
743 К |
||||
qгТi |
qгТiуi |
qгТi |
qгТiуi |
||
Н2 СН4 С2Н6 С3Н8 С4Н10 С5Н12 CnH2n-6 CnH2n CnH2n+2 Қосынды |
0.1079 0.0400 0.0921 0.0851 0.0447 0.0556 0.2585 0.0304 0.2857 1.0000 |
6374 1274 1120 1098 1095 1090 1408 1402 1399 - |
687.0 51.0 103.1 93.4 49.2 61.6 364.0 42.6 400.0 1851.9 |
6818 1383 1223 1196 1193 1186 1504 1500 1497 - |
735.2 55.3 112.5 101.8 53.6 65.9 388.8 45.6 427.8 1986.5 |
Графиктен энтальпияның qгТвых1 = 1900 кДж/кг мәні Тшығу1=724К тең боатынын анықтаймыз.
Бірінші реатордағы температуралардың ауытқуы тең болады
Т1 = Ткіру – Тшығу1 = 803 – 724 = 79К.
Бірінші реактордағы температураның тиімді төмендеуі 40 – 50 К, екінші реакторда 20 – 25К және үшіншіде 7 – 10 К болады. Бұл жағдайда екінші және үшінші реакторлардағы есептеулерді қысқарту мақсатында температураның ауытқуының максималды мәні алынды.
