
кр 1
.pdf
1.Приведите конкретные примеры и условия проведения реакций получения металлорганических соединений в результате взаимодействия металлов с другими металлорганическими соединениями.
M |
+ |
RM' |
RM |
+ |
M' |
подходит для получения более реакционноспособного соединения из менее реакционноспособного. Так, например, действием металлического лития или натрия на диалкилртуть или диарилртуть можно получить соответствующее литийили натрийорганическое соединение.
(C2H5)2Hg + 2 Na  2 C2H5Na + Hg
2 C2H5Na + Hg
Получение натрийорганических соединений и в этом случае проводят при интенсивном перемешивании в инертной атмосфере в среде углеводородов, свободных от непредельных примесей, например, в пентане, низкокипящем петролейном эфире и др. При этом металлический натрий должен быть диспергирован до мельчайших частиц (менее 25 мкм), поскольку натрийорганические соединения нерастворимы в углеводородах.
2.Приведите конкретные примеры и условия проведения реакций образования металлорганических соединений в результате взаимодействия солей металлов с
металлорганическими соединениями.
Это взаимодействие представляет собой один из самых важных и широко используемых способов получения металлорганических соединений:
MX |
+ |
RM' |
RM |
+ |
M'X |
Этот способ можно использовать для синтеза практически всех типов металлорганических соединений. Равновесие сдвинуто в сторону образования менее реакционноспособной компоненты реакции. В качестве исходных соединений чаще всего используют реактивы Гриньяра и литийорганические соединения.
По этой схеме протекает также реакция галогенидов металлов и органических галогенидов с металлическим натрием:
MX + 2 Na + RX  RM + 2 NaX
RM + 2 NaX
Вэтом случае реакция протекает в две стадии: сначала металлический натрий реагирует с органическим галогенидом с образованием натрийорганического соединения, которое сразу взаимодействует с галогенидом другого металла:
RX |
+ |
2 Na |
RNa |
+ |
NaX |
MX |
+ |
RNa |
RM |
+ |
NaX |
Эту двухстадийную реакцию чаще всего используют для получения кремнийорганических соединений, а также органических производных цинка, олова, мышьяка и сурьмы.
C6H5CH2MgCl + 2 Li |
C6H5CH2Li + LiCl + Mg |
3.Приведите примеры реакций магнийорганических и литийорганических соединений с карбонильными соединениями, со сложными эфирами, с

ортоэфирами.
Взаимодействие реактива Гриньяра с карбонильной группой представляет собой восстановительный процесс, поскольку образование новой С–С-связи приводит к превращению карбонильной группы в спиртовую:
R |
2 |
|
R |
|
|
|
R |
|
||
|
|
|
|
|
|
|
|
|
||
|
R MgBr |
|
|
|
|
H O |
|
|
|
|
C |
O |
1 |
C |
OMgBr |
2 |
1 |
C |
OH |
||
1 |
|
R |
|
R |
||||||
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
2 |
|
|
|
2 |
|
||
|
|
|
R |
|
|
|
R |
|
||
Если в этой реакции R означает атом водорода, то продуктом реакции становится вторичный спирт, а взаимодействие с реактивом Гриньяра кетона (R означает органический остаток) приводит к третичному спирту.
Литийорганические соединения реагируют с кетонами так же, как и магнийорганические соединения. Однако они более реакционноспособны, что позволяет использовать их в тех случаях, когда реактивы Гриньяра с кетонами не реагируют. В соответствии с этим реакции по карбонильным группам стерически затруднённых кетонов лучше проводить с литийорганическими соединениями. Так, например, для получения триизопропилкарбинола проводят взаимодействие диизопропилкетона с изопропиллитием:
|
|
|
|
|
|
|
|
|
|
|
CH(CH ) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
3 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(CH ) |
CH |
C |
CH(CH ) |
+ |
(CH ) |
CHLi |
(CH ) |
CH |
C |
CH(CH ) |
|||
3 2 |
|
|
|
|
3 2 |
|
3 2 |
|
3 2 |
|
|
|
3 2 |
|
|
|
|
|
|
|
|
|
|||||
|
|
O |
|
|
|
|
|
|
OLi |
|
|||
Действие реактивов Гриньяра на сложные эфиры (в приведенном выше общем уравнении R означает алкоксильную группу) также приводит к образованию третичных спиртов, поскольку образующиеся в результате первичного присоединения магнийорганического соединения аддукты разлагаются на алкоголят и кетон:
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
OR |
|
|
|
|
O |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
R |
|
C |
+ |
R2MgBr |
|
R |
|
C |
OMgBr |
|
R |
C |
+ |
1 |
||||||
|
|
|
|
|
|
R OMgBr |
||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
||||
|
|
|
|
|
|
2 |
|
|
|
|
||||||||||
|
|
|
OR |
|
|
|
|
|
|
|
R |
|
|
|||||||
|
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
O |
|
|
|
R2 |
|
H2O |
|
|
R2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
R |
|
C + R2MgBr |
R |
|
C |
|
|
OMgBr |
R |
|
C |
|
OH |
|
||||||
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
R2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
R2 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Только с эфирами муравьиной кислоты реакцию можно остановить на первой стадии. В соответствии с этим гидролиз продуктов присоединения реактивов Гриньяра к формиатам приводит к альдегидам:
|
|
|
|
OC2H5 |
H2O |
|||||
|
|
|
|
|
|
|
||||
RMgBr + HCOOC2H5 |
R |
|
C |
|
OMgBr |
|
R |
|
CHO |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
H
Гладко реагируют с реактивами Гриньяра ортоэфиры карбоновых кислот, например:

OC2H5
RMgBr + H3CC(OC2H5)3 |
H3C |
|
C |
|
R + C2H5OMgBr |
|
|
|
|||||
|
|
|
|
|||
OC2H5
4. Роль растворителей при получении литий- и магнийорганических соединений. Образование ассоциатов с участием электронодонорных растворителей.
Подходящими растворителями для получения алкильных производных лития являются такие углеводороды, как бензол, циклогексан, низшие фракции петролейного эфира. Можно использовать и диэтиловый эфир или тетрагидрофуран, но раствор алкиллития в простых эфирах надо сразу использовать в следующем далее превращении. Ароматические производные лития в отличие от алифатических с простыми эфирами не реагируют. Растворители для получения литийорганических соединений должны длительное время выдерживаться над металлическим натрием.
Накопленный опыт по проведению реакции Гриньяра показал, что растворитель играет важную роль при получении магнийорганических соединений. Более всего для этого подходит диэтиловый эфир, но можно использовать также дипропиловый, дибутиловый и диизопентиловый эфиры, а также тетрагидрофуран и диоксан. В качестве растворителя могут быть использованы и ацетали формальдегида, например, диизопропоксиметан и диизобутоксиметан. Эфир при этом должен быть абсолютным, т.е. его надо очистить от воды и спирта. Для этого его в течение достаточно длительного времени выдерживают над металлическим натрием. Количество эфира должно соответствовать образованию раствора реактива Гриньяра с концентрацией от 1 до 2 молей в литре.
В качестве среды для получения реактивов Гриньяра можно использовать углеводороды (например, бензол, толуол и петролейный эфир), но эти вещества не образуют аддукты с магнийорганическими соединениями и поэтому не растворяют их. Очень хорошие результаты получены при проведении реакции Гриньяра в додекане, изооктане или тетралине, при этом оптимальная скорость взаимодействия магния с алкилгалогенидами достигается при температуре от 80 до 100 °С, а для реакции с арилгалогенидами от 160 до 170 °С. Хорошие выходы реактивов Гриньяра получены также при проведении реакции магния с органическими галогенидами в таких углеводородах, как бензол, толуол или ксилол, к которым добавлен тетрагидрофуран или триэтиламин в количестве 1 моль на г-атом магния.
На самом деле магнийорганическое соединение растворяется в эфире в виде аддукта, экзотермический эффект образования которого поддерживает реакционную массу в состоянии кипения. Эфираты продуктов реакции магния с органическими галогенидами могут быть выделены в виде бесцветных кристаллических веществ состава, например, R2Mg∙MgX2∙4(C2H5)2O. В действительности, очевидно, в растворе устанавливается равновесие:
(RMgX)2  2 RMgX
2 RMgX  R2Mg + MgX2
R2Mg + MgX2  R2Mg.MgX2
R2Mg.MgX2
5.Синтез и использование цинкорганических соединений в органическом синтезе, реакция Реформатского, синтез кетонов.
Основной способ получения цинкорганических соединений представлен реакцией металлического цинка с алкилиодидами. При этом целесообразно использовать цинк, активированный медью. Это может быть цинк-медная пара, получаемая при нагревании цинковых стружек с порошкообразной медью или смесь цинка и меди, получаемая нагреванием цинковой пыли с цитратом меди до полного разложения цитрата.
Вреакцию с цинком вступают первичные и вторичные алкилиодиды. Получаемые в инертной атмосфере алкилцинкиодиды представляют собой белые кристаллические вещества. При нагревании они разлагаются на иодид цинка и диалкильные производные цинка:
Zn + |
RI |
RZnI |
|
|
2 RZnI |
|
ZnR |
+ |
ZnI |
|
|
2 |
|
2 |
Диалкильные производные цинка представляют собой стабильные в бескислородной атмосфере соединения, которые можно перегонять при температурах до 200 °С.
Диалкильные и диарильные производные цинка, а также соответствующие органические цинкгалогениды можно получать действием растворов реактивов Гриньяра в эфире на безводный хлорид цинка:
ZnCl |
+ |
RMgX |
RZnCl |
+ |
ZnClX |
2 |
|
|
|
|
|
ZnCl |
+ |
2 RMgX |
ZnR |
+ |
2 MgClX |
2 |
|
|
2 |
|
|
Этот способ можно также использовать для получения дивинилцинка и диаллилцинка. Ещё один способ получения диалкильных производных цинка представлен реакцией диалкильных производных ртути с металлическим цинком. Чистые диарильные
производные цинка лучше всего получаются по этой реакции при нагревании диарилртути и цинка в кипящем ксилоле или по реакции хлорида цинка с диариллитием.
Действием азометана на хлорид цинка можно получать хлорметильные производные цинка:
ZnCl |
+ |
CH N |
ClCH ZnCl |
+ |
N |
||
2 |
|
2 |
2 |
2 |
|
|
2 |
ZnCl |
+ |
2 CH N |
(ClCH ) |
Zn |
+ |
2 N |
|
2 |
|
2 |
2 |
2 2 |
|
|
2 |
Цинкорганические соединения не имеют такого препаративного значения, как реактивы Гриньяра и литийорганические соединения. Их используют в тех случаях, когда есть необходимость в проведении реакции с участием металлорганического соединения с пониженной реакционной способностью. Так, например, в реакции цинкорганических соединений с хлорангидридами карбоновых кислот образуются кетоны:
R1ZnI или R12Zn
RCOCl  RCOR1
RCOR1
Впревращениях, протекающих с участием цинкорганических соединений, определенное препаративное значение имеет реакция Реформатского, в соответствии с которой из
кетонов, металлического цинка и α-галогенированных сложных эфиров образуются эфиры β-гидроксизамещённых сложных эфиров по схеме:
CH3
RCOCH3 + Zn + BrCH2COOC2H5  R C CH2COOC2H5 OZnBr
R C CH2COOC2H5 OZnBr
Образующееся в результате взаимодействия бромацетата и цинка цинкорганическое соединение нестабильно, поэтому реакцию проводят в трёхкомпонентной системе так, чтобы оно сразу реагировало с кетоном. Реакция протекает только по кетогруппе, поскольку активности цинкорганических соединений недостаточно для взаимодействия с карбонильной группой карбоксилатного структурного элемента.
Интересная реакция кросс-сочетания с участием цинкорганических соединений представлена реакцией Негиши. В соответствии с этой реакцией органические производные цинка реагируют с разнообразными галогенидами в присутствии никелевых или палладиевых катализаторов. В качестве примера можно привести получение 2-метил-4´-нитробифенила из 2-иодтолуола и 4-бром-нитробензола по схеме:
CH |
|
|
CH |
|
CH |
|||||||||
|
|
|
3 |
|||||||||||
|
3 |
|
|
|
3 |
|
|
|
|
ZnCl |
||||
|
|
|
I |
(CH ) |
CLi |
|
|
|
Li |
ZnCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
3 3 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
CH |
3 |
|
3 |
ZnCl |
Br |
Pd(PPh ) |
|
||
|
|
3 4 |
+ |
|
NO |
|
2 |
|
|
|
NO |
|
|
2 |
6.Ртутьорганические соединения. Способы получения, химические свойства и токсичность. Гранозан (этилмеркурхлорид).
Ртутьорганические соединения исследовались достаточно широко с целью получения веществ, которые можно было бы использовать в качестве лекарственных средств и пестицидов. В соответствии с этим были разработаны многочисленные способы получения самых разных органических производных ртути. Высокая их токсичность, чаще всего превышающая токсичность элементной ртути, заставляет предпринимать особые меры предосторожности при работе с ними. Особенно опасны летучие алкильные производные ртути.
Ртутьорганические соединения достаточно инертны. В нормальных условиях они не реагируют с кислородом воздуха и с водой, поэтому работать с ними проще, чем с реакционноспособными органическими производными других металлов.
Некоторые алкилиодиды реагируют с металлической ртутью на свету или в присутствии иода с образованием алкилмеркуриодидов, но эта реакция идёт с очень низкой скоростью.
Общий способ получения диалкильных и диарильных производных ртути представлен
реакцией алкилили арилгалогенидов или же алкилсульфатов с амальгамой натрия, например:
2 RX + HgNa2  HgR2 + 2NaX
HgR2 + 2NaX
Влабораторных условиях диалкильные и диарильные производные ртути можно получать по реакции дихлорида ртути с реактивами Гриньяра или с другими реакционноспособными металлорганическими соединениями:
HgCl2 + 2 C6H5MgBr  Hg(C6H5)2 + 2 MgBrCl
Hg(C6H5)2 + 2 MgBrCl
Если в качестве исходного соединения в этой реакции используют каломель (Hg2Cl2), то образование диалкилили диарилртути сопровождается выделением металлической ртути.
Однако чаще всего их получают диспропорционированием в соответствии с уравнением:
HgR |
+ |
HgCl |
2 RHgCl |
2 |
|
2 |
|
Несимметричные диарильные, диалкильные и алкиларильные ртутьорганические соединения получают взаимодействием соответствующих органических меркургалогенидов с реактивами Гриньяра, например:
C H HgCl |
+ |
C H MgBr |
C H HgC |
H |
+ |
MgBrCl |
||||
6 |
5 |
|
2 |
5 |
6 |
5 |
2 |
5 |
|
|
Для получения солей арилртути используют реакцию Несмеянова или меркурирование ароматических соединений. По реакции Несмеянова двойные соли арилдиазония и дихлорида ртути разлагают в присутствии порошкообразной меди в холодном ацетоне или в воде:
ArN Cl.HgCl |
+ |
2Cu |
ArHgCl |
+ |
N |
+ |
Cu Cl |
||
2 |
2 |
|
|
|
|
2 |
|
2 |
2 |
Водном из вариантов реакции Несмеянова соль арилдиазония разлагают при температуре от 0 до 5 °С в присутствии диспергированной ртути.
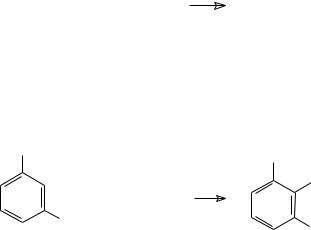
Соли арильных производных ртути очень легко получаются при прямом меркурировании ароматических соединений солями ртути. Реакция представляет собой замещение водорода атомом ртути:
ArH |
+ |
HgX |
ArHgX |
+ |
HX |
|
|
2 |
|
|
|
Вэту реакцию вступают бензол, его производные, полициклические ароматические углеводороды, а также гетероароматические соединения, например, тиофен, фуран и пиридин. Электронодонорные заместители ускоряют реакцию меркурирования. С
помощью этой реакции выделяемый из каменноугольной смолы бензол может быть очищен от содержащегося в нём тиофена. Технический бензол в течение 30 мин кипятят с водным раствором ацетата ртути, и тиофен превращается в нерастворимое в воде 2,5- димеркурированное производное. Бензол реагирует с кристаллическим ацетатом ртути при кипячении в течение нескольких часов.
Реакционная способность:
Соли ртути присоединяются по двойным связям олефинов, например, при пропускании этилена в водный раствор ацетата ртути образуется 2-гидроксиэтилмеркурацетат:
H2O
CH2  CH2 + (CH3COO)2Hg
CH2 + (CH3COO)2Hg  HOCH2CH2HgOCOCH3
HOCH2CH2HgOCOCH3
При замене в этой реакции воды на метанол получают 2-метоксиэтил-меркурацетат. Эта реакция идёт настолько легко, что её можно использовать для очистки насыщенных углеводородов от ненасыщенных, а также для очистки насыщенных кислот от ненасыщенных. В реакцию меркурирования вступают и другие соли ртути, например, нитрат, сульфат или хлорид, но тогда при меркурировании надо добавлять основание для нейтрализации выделяющейся сильной кислоты, разлагающей С–Hg-связь.
Ацетиленовые соединения присоединяют дихлорид ртути даже в присутствии сильных кислот. Так, например, ацетилен реагирует с растворённым в 15 %-й соляной кислоте дихлоридом ртути с образованием Z-изомера 2-хлорвинилмеркурхлорида. В реакции Кучерова присоединение воды по тройной связи ацетилена в присутствии сульфата ртути, протекающее с образованием изомеризующегося в ацетальдегид енола, роль катиона ртути сводится, очевидно, к образованию π-комплекса, который и реагирует с водой.
Ртутьорганические соединения в ограниченном масштабе применяются в составе протравителей семян. Чаще всего для этого используют этилмеркурхлорид (гранозан) с острой токсичностью (ЛД50) 30–50 мг/кг. У этого кристаллического вещества неожиданно высокое для солей давление паров и высокая кожно-резорбтивная активность, что делает его очень опасным. Тем не менее его применяют для протравливания семенного материала, поставляемого в рамках программ экономической помощи в беднейшие страны. Обработанное гранозаном зерно маркируется яркими красителями, но, несмотря на строжайшие запреты, голодающее население иногда употребляет в пищу это предназначенное только для посева зерно. Случаи массового отравления людей зерном, обработанным ртутными протравителями, отмечались, например, в Ираке в 60-е и 70-е годы прошлого века. Именно гранозан является основным поставщиком отрицательной статистики по смертности от пестицидов. Производство гранозана основано на реакциях:
2CHBr+HgNa |
Hg(CH) +2NaBr |
|
25 |
2 |
252 |
Hg(CH) +HgCl |
2CHHgCl |
|
252 |
2 |
25 |
Сначала действием этилбромида на амальгаму натрия получают диэтилртуть, которая по реакции с сулемой превращается в этилмеркурхлорид. Важно, что частое употребление протравителей с ртутьорганическими соединениями приводит к заражению почвы этим тяжёлым металлом. Попадающие в организм соединения ртути выводятся очень медленно, поэтому при регулярном употреблении пищи или воды даже с минимальными концентрациями ртути происходит её накопление с самыми серьёзными последствиями для здоровья. В качестве примера можно привести массовое отравление жителей посёлков, расположенных на побережье залива Минамата, в Японии, в середине 50-х гг. прошлого века. Симптомы отравления выражались в нарушении координации движений, потере слуха, припадках. Смертность поступавших на лечение составляла около 40 %. Проведённое исследование показало, что отравление вызывается употреблением в пищу морепродуктов из залива, в который поступали содержащие соли ртути сточные воды химического предприятия. Включаясь в
метаболические процессы в микроорганизмах неорганические соли ртути превращались в метилртуть, которая накапливалась в питающихся микроорганизмами морепродуктах.
7. Способы получения и реакционная способность органических производных элементов первой группы Таблицы Менделеева. Реакция Вюрца и ВюрцаФиттига, область практического применения.
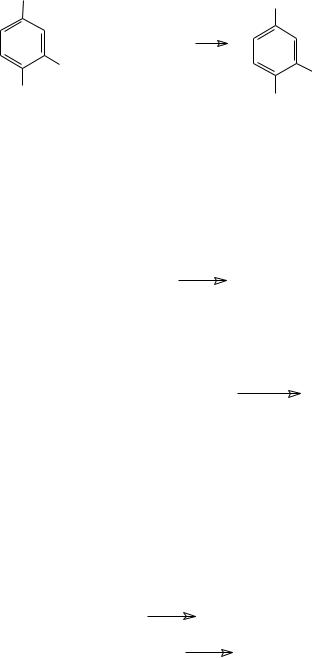
Основной способ получения литийорганических соединений основан на реакции металлического лития с соответствующим галогенидом. Так, например, в метилале СН2(ОСН3)2 действием лития на хлорметиловый эфир можно получить метоксиметиллитий, который несколько дней может храниться при температуре –70 °С, тогда как при температуре около 0 °С он разлагается в течение нескольких часов. Нельзя использовать для получения литийорганических соединений иодиды, поскольку они реагируют по схеме реакции Вюрца. В алифатическом ряду предпочтительно использовать алкилхлориды, а в ароматическом ряду – соответствующие бромиды. Ароматические производные лития в отличие от алифатических с простыми эфирами не реагируют.
Некоторые простые эфиры реагируют с металлическим литием так же, как и алкилили арилгалогениды. Так, например, бензиллитий может быть получен с хорошим выходом из бензилалкиловых эфиров в тетрагидрофуране.
При необходимости получения литийорганичекого соединения в чистом виде без растворителя используют реакцию ртутьорганического соединения с металлическим литием. Взаимодействие проводят в среде углеводорода. После завершения реакции отделяют органическую фазу от выделившейся ртути декантированием и отгоняют растворитель. При получении этиллития из диэтилртути в бензоле это литийорганическое соединение при охлаждении выпадает из реакционной массы в виде крупных кристаллов.
Литийорганические соединения можно также получать из реактивов Гриньяра. В качестве примера можно привести реакцию бензилмагнийхлорида с металлическим литием:
C H CH MgCl |
+ |
2 Li |
C H CH Li |
+ |
LiCl |
+ |
Mg |
||||
6 |
5 |
2 |
|
|
6 |
5 |
2 |
|
|
|
|
Возможны также обменные реакции между различными металлорганическими соединениями, если один из продуктов реакции нерастворим в используемом растворителе.
Ещё один способ получения литийорганических соединений представлен взаимодействием, например, фениллития с ароматическим соединением с активированным атомом водорода:
OCH3 |
|
|
OCH3 |
|
|
|
|
|
|
|
Li |
|
|
+ C6H5Li |
+ C6H6 |
|
|
|
|
|
OCH3 |
|
OCH3 |
|
|
|
Взаимодействие литийорганических соединений с органическими галогенидами обычно протекает по реакции Вюрца-Фиттига с образованием С–С-связи, однако в реакциях с галогенированными гетероциклами, ароматическими простыми эфирами и
алкилбензиловыми эфирами может идти обменная реакция, например:
OCH3 |
|
|
OCH3 |
|
|
|
|
|
|
+ C6H5Li |
+ C6H5Br |
|
|
|
|
|
OCH3 |
|
OCH3 |
|
|
|
|
Br |
|
|
Li |
|
|
|
Натрийорганические соединения могут быть получены теми же способами, что и соответствующие литийорганические соединения, однако при этом следует принимать во внимание, что натрийорганические соединения более реакционноспособны, чем их литиевые аналоги. Вследствие этого они могут реагировать с исходным галогенидом по реакции Вюрца-Фиттига или с используемым для проведения реакции растворителем. Ранее для получения натрийорганических соединений использовали реакцию металлического натрия с органическими производными цинка, кадмия, свинца и, прежде всего, ртути в инертном растворителе, например:
(C H ) |
Hg |
+ |
2 Na |
2 C H Na + |
Hg |
||
2 |
5 2 |
|
|
|
2 |
5 |
|
Действием металлического натрия можно замещать атомы водорода в таких углеводородах, как алкины, флуорены, триарилметаны; действием натрия на диметилсульфоксид получают метилсульфинилметанид натрия, который можно использовать, например, для получения ацетиленидов натрия по реакции:
RC |
|
CH + CH3SOCH2Na |
RC |
|
CNa + (CH3)2SO |
|
|
||||
|
|
||||
|
|
Этот способ замещения атомов водорода натрием через производное диметилсульфоксида можно использовать и для получения других труднодоступных натрийорганических соединений. Металлирование натрийорганическими соединениями протекает значительно легче, чем литийорганическими соединениями. Так, например, фенилнатрий можно получить действием этилнатрия на бензол.
Ещё более высокой реакционной способностью отличаются калийорганические соединения. Если, например, в толуоле можно проводить реакцию хлорбензола с натрием с получением фенилнатрия, то реакция хлорбензола с калием в толуоле даже при низких температурах приводит к получению с хорошим выходом бензилкалия. Реакция протекает по схеме:
C H Cl |
+ |
2 K |
|
C H K + |
KCl |
|
|
|
||||
6 |
5 |
|
|
|
|
6 |
5 |
|
|
|
|
|
C H CH |
+ |
C H K |
|
C H CH K |
+ |
C H |
||||||
6 |
5 |
3 |
|
6 |
5 |
|
6 |
5 |
2 |
|
6 |
6 |
Реакционная способность алкильных производных калия настолько велика, что они могут реагировать с атомами водорода у первичных и вторичных атомов углерода даже в таких инертных веществах, как пентан или циклогексан.
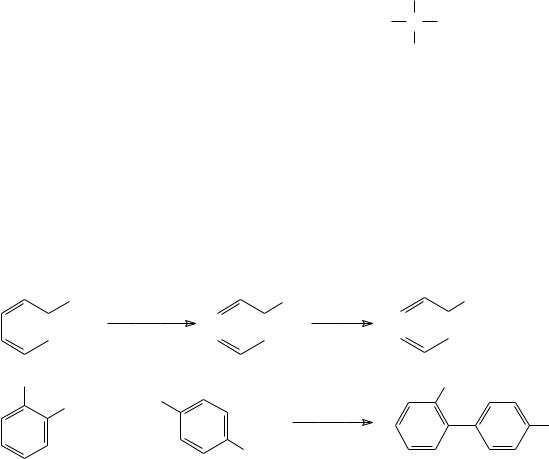
Основная область применения натрийорганических соединений представлена реакцией Вюрца, в которой они образуются в качестве промежуточных продуктов. В общем случае реакция Вюрца представляет собой отщепление атомов галогена от двух молекул алкилгалогенида при действии щелочного металла в соответствии с уравнением:

2 RX + 2 Na |
R |
|
R + 2 NaX |
|
В настоящее время эта реакция используется только для получения длинноцепочечных соединений алифатического ряда.
Р. Фиттиг распространил эту реакцию на получение алкилированных ароматических соединений из арилгалогенидов и алкилгалогенидов. При действии натрия на смесь ароматического и алифатического галогенидов с более высокой скоростью образуется арилнатрий, который, в свою очередь, реагирует преимущественно с алкилгалогенидом, а не с арилгалогенидом. В соответствии с этим основным продуктом реакции становится алкилированное ароматическое соединение, например:
C6H5Br + 2 Na + (CH3)2CHCH2Br  C6H5CH2CH(CH3)2 + 2 NaBr
C6H5CH2CH(CH3)2 + 2 NaBr
В представленной реакции основным продуктом взаимодействия становится изобутилбензол, тогда как 2,5-диметилгексан и бифенил образуются лишь в незначительных количествах. По реакции Вюрца–Фиттига можно получать алкилированные ароматические соединения с алифатическими радикалами, которые не могут быть получены по реакции Фриделя–Крафтса алкилированием ароматических углеводородов соответствующими галогенированными соединениями. Так, например, в реакции бензола с изобутилбромидом в присутствии кислоты Льюиса образуется третбутилбензол, а не изобутилбензол.
Оказалось также, что в реакции Вюрца–Фиттига вместо металлического натрия можно использовать нафтилнатрий, образующийся из нафталина и натрия в тетрагидрофуране. Действие этого реагента на бензилхлорид приводит к образованию 1,2-дифенилэтана с выходом до 90 %.
8.Реакция Барта и реакция Несмеянова, применение для получения ртутьорганических соединений. Реакции диазометана с солями металлов.
Один из важных способов получения интересных в фармакологическом отношении ариларсониевых солей представлен взаимодействием хлоридов арилдиазония с арсенитами натрия (реакция Барта, H. Bart, 1910 г.):
C H N Cl |
+ |
Na HAsO |
C H AsO HNa |
+ |
NaCl |
+ |
N |
|||||
6 |
5 |
2 |
|
2 |
3 |
6 |
5 |
3 |
|
|
|
2 |
По аналогичной схеме могут быть получены и арильные производные сурьмы.
Реакция Барта сопровождается окислительным превращением вступающего в реакцию с солью диазония атома металла. Для металлов, которые не могут повышать свою валентность в окислительных превращениях, А. Н. Несмеяновым (1929 г.) был предложен способ арилирования солями диазония в присутствии металла восстановителя. В соответствии с реакцией Несмеянова арильные металлорганические соединения образуются при разложении солей арилдиазония с солями металлов или при разложении комплексных соединений из солей арилдиазония и солей металлов в присутствии, например, дисперсной меди, порошкового железа и других металлов:
RN Cl.HgCl + 2Cu |
RHgCl + Cu Cl |
+ N |
||
2 |
2 |
2 |
2 |
2 |
Многие галогениды металлов реагируют с диазометаном с образованием
