
- •Классификация химических реакций
- •Скорость реакции
- •Критерии простой реакции:
- •Рассмотрим интегральные методы
- •2 Метод – метод подбора уравнений
- •Алгоритм решения в общем виде:
- •Константа скорости второго порядка реакции нитроэтана(нэ) со щелочью
- •3 Тип кинетических данных– для реакции : Даны только начальные концентрации реагентов и зависимость изменения общего свойства системы от времени.
Алгоритм решения в общем виде:
Решение: 1. Предполагаем порядок простой реакции = I .
2. Записываем выражение для скорости реакции
3. Выбираем из таблицы интегральное выражение для данной реакции
4. Находим k по крайней мере для трех точек и подтверждает правильность
выбора порядка реакции и затем находим 1/2
2 тип кинетических данных– для реакции : Даны только начальные концентрации реагентов и зависимость изменения концентрации только одного из участников реакции от времени.
Пример 2.
Для газофазной реакции
N2O5 = N2O4 + ½ O2
При 25оС получены следующие опытные данные:
, мин………,,0 20 30 40 50 60
Р(О2), атм…… 0 0,821 1,237 1,640 2,051 2,470 5,000
Определить порядок реакции, значение константы скорости, время полупревращения и записать выражение для скорости реакции
Как видно из экспериментальных данных в задаче имеется только информация о кинетической кривой продукта реакции О2, в то время как нам необходима информация о кинетической кривой исходного N2O5 . Для связи концентраций между собой используем уравнение материального баланса (МБ).
Уравнение материального баланса (МБ) в общем виде имеет вид:
Сi = Coi (i/ст)*хст ,
где ст и хст – стехиометрический коэффициент и изменение концентрация любого вещества по которому есть информация в задаче.
относится к типу вещества – исходное (-) и конечное (+)
Уравнение материального баланса справедливо и для числа молей
ni = noi (i/ст)*хст
и для давления: Рi = Рoi (i/ст)*хст
Алгоритм решения:
1. Предполагаем порядок простой реакции = I .
2. Записываем выражение для скорости реакции
3. Выбираем из таблицы интегральное выражение для данной реакции
4. Используя уравнения материального баланса находим зависимость
концентрации всех исходных реагентов от времени
5. Находим k по крайней мере для трех точек и подтверждает правильность
выбора порядка реакции и затем находим 1/2
Решение
По уравнению МБ запишем выражение для давления N2O5 :
хст = хО2 и Р(N2O5) = Р0(N2O5) - (1/½)*хО2 = Р0(N2O5) - 2*хО2 .
Аналогично: Р(О2) = Р0(О2) - (½/½)*хО2 = Р0(О2) - *хО2 .
По условию задачи: Р0(О2) = Р(О2) при t = 0 и следовательно Р0(О2) = 0
В задаче отсутствует значение Р0(N2O5), которое тоже можно найти из МБ.
При бесконечно большом времени Р(N2O5) = 0 (весь реагент прореагировал), тогда
Р(N2O5) = Р0(N2O5) - 2*хО2 = 0 отсюда Р0(N2O5) = 2*хО2 =2*5 = 10 атм
Окончательно имеем уравнение связи:
Р(N2O5) = Р0(N2O5) - 2*хО2 = 2*хО2 - 2*хО2 . Полученные данные запишем в таблицу
, мин………, 0 20 30 40 50 60
Р(О2), атм…… 0 0,821 1,237 1,640 2,051 2,470 5,000
Р(N2O5), атм 10 8,358 7,526 6,720 5,898 5,060
Допустим, что n =0 . Из таблицы кол. 2.1 Р(N2O5) = Р0(N2O5) - k, значит график в координатах Р(N2O5) = f() должна быть прямая линия.
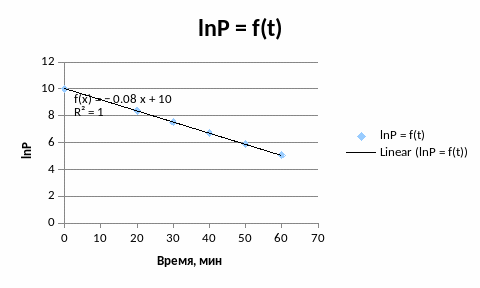
Тангенс угла наклона tg = - k = -0,0822 и k = 8,22*10-2 1/мин
Время полупревращения 1/2 = РA0/2k = 10/2*8,22*10-2 = 60,83 мин
Выражение для скорости реакции r = kР0 = k
Задачи, включающие степень превращения.
Очень часто в реакции приводится степень превращения i для исходных реагентов вместо данных по изменению С или Р .
Степень превращения относится только к исходным реагентам и следовательно
хст = хi,исх
Запишем выражение для i : i = (Coi - Сi)/Coi
Запишем уравнение МБ для исходного вещества (i):
Сi = Coi - хi ; отсюда хi = Coi – Сi.
Подставим в выражение для i = (Coi - Сi)/Coi = хi /Coi и окончательно:
i = хi /Coi и хi = i *Coi
Таким образом можно легко выразить хi через степень превращения в уравнении МБ
Пример 3.
