
- •Классификация химических реакций
- •Скорость реакции
- •Критерии простой реакции:
- •Рассмотрим интегральные методы
- •2 Метод – метод подбора уравнений
- •Алгоритм решения в общем виде:
- •Константа скорости второго порядка реакции нитроэтана(нэ) со щелочью
- •3 Тип кинетических данных– для реакции : Даны только начальные концентрации реагентов и зависимость изменения общего свойства системы от времени.
Крылов А.В.
Семинар по кинетике простых реакций.
Классификация химических реакций
Простые реакции (элементарная стадия сложной реакции) является совокупностью однотипных элементарных химических актов, представляющих собой превращение реагентов в продукты за короткий отрезок времени (порядка 10−13 с для адиабатических и 10−15 с для неадиабатических реакций). Стехиометрическое уравнение реакции описывает реальное взаимодействие т.е. представляет собой механизм химической реакции.
Химические реакции в своем большинстве являются сложными, т. е., включают несколько элементарных (простых) стадий.
В этом случае механизм химической реакции – это совокупность элементарных стадий сложной реакции, связанных общими реагентами и промежуточными продуктами
Химические реакции, протекающие в гомогенных системах (в их объеме), называются гомогенными, т.е. осуществляются в смеси газов, в жидком растворе, реже – в твердой среде
Химические реакции, протекающие на границе раздела различных, называются гетерогенными, например:
- твердое тело – газ
- твердое тело – жидкость
- жидкость - газ
- жидкость - жидкость
Существуют также гомогенно-гетерогенные реакции – это сложные химические реакции, в которых одни стадии являются гомогенными, а другие – гетерогенными.
Скорость реакции
Скорость реакции — это изменение количества вещества (исходного или продукта) в единицу времени в единице реакционного пространства (R), рассчитанное на единицу его стехиометрического коэффициента (закон действующих (действия ) масс , установленный Гульдбергом и Вааге 1879 г)::
ri
=
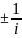 *
*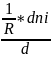
Для гомогенных реакций, протекающих в объеме, реакционным пространством является объем (R ≡V ) и в закрытой системе
ri
=
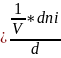 =
=

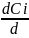 ; [моль/л*с]
; [моль/л*с]
Для реакции в газовой среде могут использоваться вместо концентрации их парциальные давления pi :
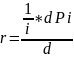
скорость такой химической реакции, измеряют в Па/с
Если реакция гетерогенная и протекает на границе фаз, то реакционным пространством является поверхность (R ≡ S).
ri
=
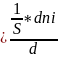 ; [моль/м2*с]
; [моль/м2*с]
В закрытых системах изменение количества вещества с течением времени происходит только за счет протекания в них химических реакций:
АА + ВВ СС + DD
Скорость реакции не зависит от выбора реагента, она всегда положительна
Пример: СOCl2 CO + Cl2
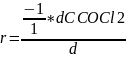 =
=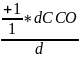 =
=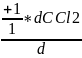
Кинетическое уравнение это зависимость скорости реакции от концентрации регантов. Для простых реакций или элементарных стадий сложных реакций справедлив закон действующих масс (действия масс), установленный Гульдбергом и Вааге 1879 г:

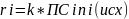 ,
где
,
где
k – коэффициент пропорциональности, называемый константой скорости реакции, или удельной скоростью реакции.
Величина k численно равна скорости реакции при концентрациях всех реагентов, равных единице. Она является величиной постоянной при данной температуре;
ni – порядок реакции по i-му реагенту
Общий порядок реакции n – сумма показателей степеней при концентрациях всех реагентов: n = ni , где n = 1,2 и редко 3
В кинетике химические реакции разделяют по признаку молекулярности реакции и по признаку порядка реакции.
Молекулярность химической реакции – это число частиц-реагентов (молекул, атомов, радикалов), одновременно участвующих в элементарном химическом акте.
Различают мономолекулярные, бимолекулярные и тримолекулярные реакции.
СOCl2 CO + Cl2 – мономолекулярная реакция
2NO2 N2O4 – бимолекулярная реакция
С2H4 + Cl2 С2H4Cl2 - бимолекулярная реакция
2NO + Cl2 продукт - тримолекулярная реакция
