
УЧЕБНОЕ ПОСОБИЕ К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО ХИМИИ
Утверждено на заседании каф. 908
1 сентября 2012 г
Часть 2-ая
1. Стехиометрические расчеты
Пример
1. При
![]() и давлении 99300 Па некоторое количество
газа занимает объём 152 мл. Найти какой
объём займет это же количество газа при
и давлении 99300 Па некоторое количество
газа занимает объём 152 мл. Найти какой
объём займет это же количество газа при
![]() и давлении
101330 Па.
и давлении
101330 Па.
Решение. Зависимость между объёмом газа, давление и температурой можно выразить уравнением:
![]() ,
(1.1)
,
(1.1)
объединяющим
законом Бойля-Мариотта и Гей-Люссака,
где P
и V
– давление и объем газа при данной
температуре Т ;
![]() - давление и объём газа при нормальных
условиях.
- давление и объём газа при нормальных
условиях.
Нормальными
условиями
(н.у.) называются условия, когда температура
равна
![]() или 273 К и давление – 101325 Па (760 мм рт. ст.
или 1 атм.). Подставляя данные задачи в
уравнение (1.1), получим:
или 273 К и давление – 101325 Па (760 мм рт. ст.
или 1 атм.). Подставляя данные задачи в
уравнение (1.1), получим:
![]()
Пример
2. Смешивая
2 л
![]() и 4 л
и 4 л
![]() , взятых при одинаковом давлении, равном
100000 Па; объем 6 л. Определить парциальные
давления газов в смеси.
, взятых при одинаковом давлении, равном
100000 Па; объем 6 л. Определить парциальные
давления газов в смеси.
Решение. Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же условиях объём всей газовой смеси.
Согласно
закону парциальных давлений, общее
давление смеси газов, не вступающих
друг с другом во взаимодействие, равно
сумме парциальных давлений газов,
составляющих смесь
(закон Дальтона). По
условию задачи после смешения газов
объем кислорода увеличится в
![]() раза,
объем
раза,
объем
диоксида
серы
![]() в
в
![]() раза. Во сколько же раз уменьшилось
парциальное давление газов.
раза. Во сколько же раз уменьшилось
парциальное давление газов.
Следовательно,
![]()
Пример
3. Смешивают
3 л
![]() 4 л
и 6 л
4 л
и 6 л
![]() До смешения давление
До смешения давление
![]() составляло соответственно 96000, 108000 и
90600 Па. Общий объем смеси 10 л. Определить
давление смеси.
составляло соответственно 96000, 108000 и
90600 Па. Общий объем смеси 10 л. Определить
давление смеси.
Решение. Аналогично предыдущей задаче находим парциальные давления отдельных газов:

Общее давление смесей равно сумме парциальных давлений:
![]()
Пример 4. Какой объем V0 займут при нормальных условиях 120 мл азота, собранного над водой при 20 0С и давлении 100000 Па? Давление насыщенного пара воды при 20 0С равного 2300 Па.
Решение. Если газ собран над жидкостью, то при расчетах следует иметь в виду, что его давление является парциальным и равно разности общего давления газовой смеси и парциального давления пара жидкости.
Парциальное давление азота равно разности общего давления и парциального давления пара воды:
![]()
Далее находим
![]()
Пример 5. Какова молекулярная масса газа, если 28,6 г его при нормальных условиях занимают объем 10 л?
Решение. Молярная масса М – масса одного моля вещества, выраженная в граммах, численно равна относительной молекулярной массе этого вещества, выраженной в атомных единицах массы – а.е.м., равная 1/12 части массы атома изотопа углеводорода 12С.
Согласно следствию из закона Авогадро, 1 моль любого газа при нормальных условиях занимает объем 22,4 л. Поэтому можно записать:
![]() (1.2)
(1.2)
где М – мольная масса газа, г; m – масса данного газа, г; V0 – объем, занимаемый массой данного газа при нормальных условиях, л.
Из уравнения (1.2) находим
![]()
что соответствует молекулярной массе 64,06 а.е.м.
Пример 6. Сколько молекул содержится в 1мл H2O при 40С?
Решение. Согласно еще одному следствию из закона Авогадро моль любого вещества при нормальных условиях содержит 6,02∙1023 структурных единиц (молекул, атомов, ионов).
Известно, что плотность воды при 40С dH2O = 1 г/см3, следовательно, нам дан 1 г H2O. МH2O = 18 г. Составляем пропорцию:

Пример 7. Масса 1 л азота при нормальных условиях 2,143 г. Определить мольную массу азота и его плотность по воздуху.
Решение. Масса одного литра газа называется абсолютной плотностью газа и находится из соотношения
![]() (1.3)
(1.3)
где d – абсолютная плотность газа; М – мольная масса данного газа. Подставив данные задачи и формулу, найдем
![]()
Плотность по какому-либо известному газу D (относительную плотность) можно найти из отношения молекулярных масс данного газа и известного газа – в данном случае воздуха:
![]()
где Dвозд – относительная плотность.
Отсюда
![]()
Пример 8. Вычислить молекулярную массу бензола, зная, что масса 600 мл его при 370С и давлении 83200 Па равна 1,30 г.
Решение. Массу (m, кг), температуру (T, K), давление (P, Па) и объем (V, м3) газа с его мольной массой связывает уравнение Клайперона – Менделеева:
![]() (1.4)
(1.4)
Отсюда
![]()
где R – газовая постоянная, равная 8,32 Дж/моль К.
Выразим данные задачи:
![]()
и подставив их в уравнение Клайперона – Менделеева, находим
![]()
что соответствует молекулярной массе 78 а.е.м.
Пример 9. При сгорании 2 г двухвалентного металла образовалось 3,315 г оксида. Определить эквивалент металла и его атомную массу.
Решение. Эта задача решается на основе закона эквивалентов, согласно которому: «Все вещества взаимодействуют между собой таким образом, что количество эквивалентов одного из реагирующих веществ всегда равно количеству эквивалентов другого».
Эквивалентом элемента (Э) называется такое его количество, которое соединяется (или замещается в реакции) с 1.008 весовыми частями водорода или с 8 весовыми частями кислорода.
Химический эквивалент выражается в а.е.м. Количество граммов вещества, соответствующее химическому эквиваленту, называется грамм – эквивалентом (г – экв.)
Найдем массу кислорода, которая пошла на окисление металла:
![]()
Количество эквивалентов металла и кислорода равны друг друга, поэтому можно записать
![]() (1.5)
(1.5)
или
![]() (1.6)
(1.6)
Соотношения (1.5) и (1.6) являются математическим выражением закона эквивалентов, который можно сформировать еще и следующим образом: « Массы реагирующих веществ относятся как их эквиваленты».
Подставив в последнее выражение данные задачи, определим эквивалент металла:
![]()
Эквивалент элемента (Э), атомная масса (А) и валентность (В) связана соотношением
![]()
Так как валентность металла равна двум, то A = Э∙2 = 12∙2 = 24,4.
Пример 10. В хлористом кальции, кальций и хлор находится в соотношении 36:64, исходя из формулы (1.6), это отношение должно равняться отношению их эквивалентов, т.е. 36:64 = ЭCa : ЭCl , откуда:
![]()
Пример 11. Вычислить эквиваленты, основания и соли в следующих реакциях нейтрализации:
![]() (1.7)
(1.7)
![]() (1.8)
(1.8)
![]() (1.9)
(1.9)
![]() (1.10)
(1.10)
Решение. Понятие эквивалентов и закон эквивалентов распространяется и на сложные вещества. Для обменного процесса эквивалент вещества рассчитывается по формуле:
![]() (1.11)
(1.11)
где M – молекулярная масса вещества; ni – число ионов, отдаваемых или принимаемых одной частицей (молекулой или ионом); Zi - абсолютная величина их заряда.
В реакции (1.7) участвовали все три иона водорода H+ кислорода, два иона OH- основания и при образовании соли замещались металлом шести ионов водорода. Поэтому

В реакции (1.8) участвовали два иона водорода кислоты, оба гидроксила основания и в образовании соли участвовало два эквивалента кислоты (и два эквивалента основания):
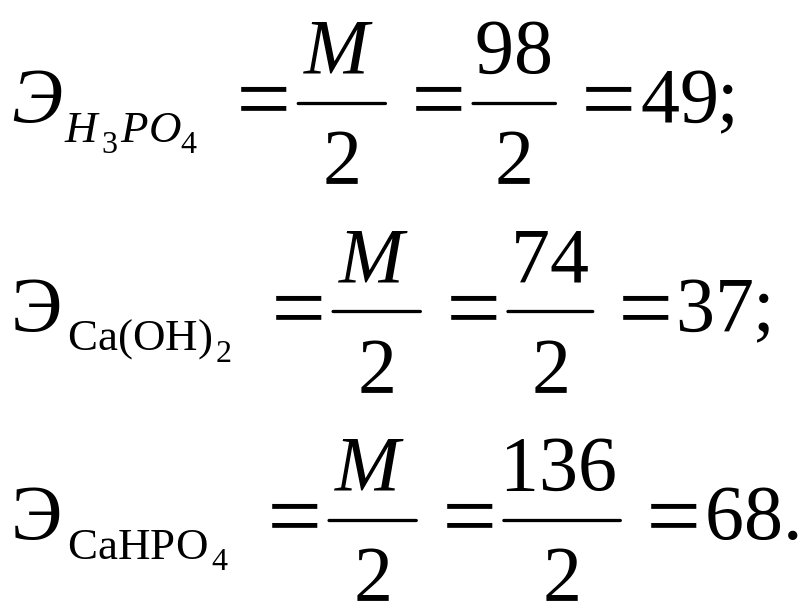
Проводя аналогичные рассуждения, вычисляем эквиваленты вещества и реакциях (1.9) и (1.10):


Пример 12. Некоторое количество металла, грамм – эквивалент которого равен 28 г, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла.
Решение. При решении некоторых задач, содержащих сведенья об объемах газообразных участников реакции, целесообразно пользоваться значением эквивалентного объема.
Эквивалентным объемом называется объем, занимаемый при данных условиях 1 г – эквивалентом вещества. Значение эквивалентного объема при н.у. можно найти из закона Авогадро (1.2). Так, эквивалентный объем водорода
![]()
Эквивалентный объем кислорода
![]()
тогда:
 Задачи
Задачи
ЗАДАЧИ
1. При 170С некоторое количество газа занимает объем 580 мл. Какой объем займет это же количество газа при 1000С, если давление его остается неизменным?
2. Давление газа, занимающего объем 2,5 л, равно 121600 Па. Чему будет равно давление, если, не изменяя температуру, сжать газ до объема 1л?
3. При 270С и давления 720 мм рт.ст. объем газа равен 5 л. Какой объем займет это же количество газа при 390С и давлении 104000 Па?
4. В стальном баллоне вместимость 12 л находится при 00С кислород под давление 15200 Па. Какой объем кислорода, находящегося при нормальных условиях, можно получить из такого баллона?
5. При давлении 987000 Па и температуре 910С некоторое количество газа занимает объем 608 мл. Найти объем газа при нормальных условиях.
6. Смешивают 0,04 м3 азота, находящегося под давлением 96000 Па, с 0,02 м3 кислорода. Общий объем смеси 0,06 м3, а общее давление 972000 Па. Каким было давление взятого кислорода?
7. Газовая смесь приготовлена из 2 л H2 (Р = 93300 Па) и 5 л СН4 (Р = 112000 Па). Объем смеси равен 7 л. Найти парциальное давление газа и общее давление смеси?
8. Газовая смесь состоит из N2 и СО2. Вычислить объемное содержание газовой смеси (в %), если парциальные давления равны соответственно 36300 и 70400 Па.
9. Газовая смесь приготовлена из 0,03 м3 СН4, 0,04 м3 Н2 и 0,01 м3 СО. Исходные давления СН4, Н2 и СО составляли соответственно 96000, 84000 и 108800 Па. Объем смеси равен 0,08 м3. Определить парциальные давления газов и общее давление смеси.
10. Одинаково ли число молекул в 1 г Н2 и в 1 г О2, в 1 моле Н2 и в 1 моле О2 при одинаковых условиях?
11. Сколько молекул содержатся в 100 мл водорода при нормальных условиях?
12. Какой объем при нормальных условиях занимают 27∙1021 молекул газа?
13. На вопрос, какой объем занимает 1 моль воды при нормальных условиях, получен ответ: 22,4 л. Правильный ли это ответ?
14. Определить объем, занимаемый 0,07 кг N2 при 210С и давлении 142000 Па.
15. Бертолетова соль (КClO3) при нагревании разлагается с образование KCl и О2. Сколько литров кислорода при 00С и давлении 101300 Па можно получить из 1 моля KClO3?
16. Чему равно атмосферное давление на вершине Казбека, если при 00С масса 1 л взятого там воздуха равна 700 мг?
17. В замкнутом сосуде при 1200С и давлении 600000 Па находится смесь, состоящая из трех объемов О2 и одного объема CH4. Каково будет давление в сосуде, если взорвать смесь и привести содержимое сосуда к первоначальной температуре?
18. Подъемная сила вычисляется как разность веса 1 м3 воздуха и 1 м 3 данного газа при одинаковых условиях. Рассчитайте и сравните подъемную силу водорода и гелия.
19. Масса 200 мл ацетилена при нормальных условиях равно 0,232 г. Определить мольную массу ацетилена.
20. Масса 0,001 м3 газа (00С, 101330 Па) равна 1,25 г. Вычислить: а) мольную массу газа; б) массу одной молекулы газа в граммах.
21. Масса 0,001 м3 газа при нормальных условиях равно 0,0021 кг. Определить мольную массу газа и его плотность по воздуху.
22. Плотность элемента по кислороду равна 0,875. Определить молекулярную массу газа.
23. Вычислить молекулярную массу ацетона, если масса 500 мл его паров при 370С и давлении 96000 Па равна 0,93 г.
24. Какой объем займет 1 кг воздуха при 170С и давлении 101330 Па?
25. Масса колбы вместимостью 750 мл, наполненная при 270С кислородам, равна 83,3 г. Масса пустой колбы составляет 82,1 г. Определить давление кислорода.
26. Вычислить массу 1 м3 воздуха при 170С и давлении 83200 Па.
27. В стальном баллоне емкостью 20 л находится водород. При 120С давление его равно 12665,625 КПА. Определить массу водорода.
28. Имеется литр кислорода при 00С и давлении 101325 Па и литр двуокиси углерода при 270С и давлении 119990,13 Па. В каком из них содержится больше молекул? Во сколько раз?
29. При сгорании 5,00 г металла образуется 9,44 г окисла металла. Определить эквивалент металла.
30. Одно и то же количество металла соединяется с 0,2 г кислорода и с 3,17 г одного из галогенов. Определить эквивалент галогена.
31. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21 г магния, эквивалент которого равен 12?
32. При растворении в кислоте 3,06 г металла выделилось 2,8 л водорода, измеренного при нормальных условиях. Вычислить эквивалент металла.
33. Определить эквивалент металла, 2 г которого вытесняют из раствора медной соли 1,132 г меди. Эквивалент меди равен 31,82.
34. 1 г некоторого металла соединяется с 1,78 г серы или с 8,89 брома. Найти эквиваленты брома и металла, зная, что эквивалент серы равен 16.
35. 1,6 г кальция и 2,615 г цинка вытесняют из кислоты одинаковые количества водорода. Найти эквивалент цинка, зная, что эквивалент кальция равен 20 г.
36. Некоторое количество металла, эквивалент которого равен 28 г, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
37. На восстановление 1,8 г оксида металла израсходовано 833 мл водорода, измеренного при нормальных условиях. Рассчитать эквивалент оксида и эквивалент металла.
38. Для растворения 16,86 г металла потребовалось 14,7 г серной кислоты, эквивалент которой равен 49. Определить эквивалент металла и объем выделившегося при его растворении водорода.
39. Определить эквивалент хлорного железа, зная, что 1,355 г его взаимодействуют без остатка с 1 г едкого натра, эквивалент которого равен 40 г.
40. Мышьяк образует два оксида, из которых один содержит 65,2 % As, а другой 75,8 % As. Определить эквивалент мышьяка в обоих оксидах.
41. В соляной кислоте растворили 3 г металла, эквивалент которого равен 12 г. Сколько литров водорода выделилось при этом (условия нормальные)?
42. Определить эквивалент углерода в метане СН4, этилене С2Н4, ацетилене С2Н2.
43. При восстановлении водорода 7,2 г оксида металла образуется 1,8 г воды. Определить эквивалент металла.
44. При взаимодействии с кислотой магния, кальция и алюминия выделилось одно и то же количество водорода. Определить, какого металла нужно для этой цели наименьшее количество.
