
- •Конспект лекций
- •Лекция 1 Энерготехнологическая переработка низкосортных топлив
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •6 Формирование аналогов опорного знания мысленными образами
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •6 Формирование аналогов опорного знания мысленными образами
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •Применение новых опорных знаний
- •5Синтез
- •6 Формирование аналогов опорного знания мысленными образами
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •6 Формирование аналогов опорного знания мысленными образами
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •Формирование аналогов опорного знания мысленными образами
- •1Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •6 Формирование аналогов опорного знания мысленными образами
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •6 Формирование аналогов опорного знания мысленными образами
- •Лекция 8 « Регенеративный подогрев питательной воды»
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •6 Формирование аналогов опорного знания мысленными образами
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •1 Формирование исходных знаний
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знаний
- •5 Синтез
- •6 Формирование аналогов опорного знания мысленными образами
- •1 Формирование исходных знании
- •2 Изучение нового материала
- •3 Анализ
- •4 Применение новых опорных знании
- •5 Синтез
- •6 Формирование аналогов опорного знания мысленными образами
5 Синтез
Горение топлива в топке начинается после его воспламенения, в присутствии кислорода любое вещество подвергается окислению даже при низких температурах. Однако при этом окисление идёт очень медленно. По мере повышения температуры интенсивность окисления возрастает. Различают по интенсивности окисления две области температур. В первой из них тепло, выделяющееся при окислении, не в состоянии поддерживать температуру горючего вещества идущего на горение воздуха или кислорода выше температуры окружающей среды. В области же высоких температур окисление идёт интенсивно, температура поднимается до величины, значительно превышающей температуру окружающей среды, и поддерживается самим процессом окисления.
Расчёт констант равновесия [10].
 ,
кДж/моль; (2.2)
,
кДж/моль; (2.2)
Приняв за единицу измерения 1 кг и соответственно 1 килограмм-молекулу (моль), получим количество молекул составляющих в уравнении образования диоксида углерода:
С+О2=СО2;
12кгС+32кгО2=44кгСО;
 моль;
(2.3)
моль;
(2.3)
 моль;
моль;
 моль;
моль;
 м3;
м3;
 м3.
м3.
 ,
кДж/моль; (2.4)
,
кДж/моль; (2.4)
12кгС+16кгО2=284кгСО;
 моль;
моль;
 моль;
моль;
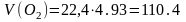 м3;
м3;
 м3.
м3.
 ,
кДж/моль; (2.5)
,
кДж/моль; (2.5)
12кгС+44кгСО2=56кгСО;
 из
первой реакции
из
первой реакции
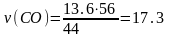 моль;
моль;
 м3.
м3.
3.1.
 ,
кДж/моль; (2.6)
,
кДж/моль; (2.6)
12кгС+18кгН2О=28кгСО+2кг.Н2;
 моль;
(2.7)
моль;
(2.7)
 моль;
моль;
 м3;
м3;
 моль;
моль;
 м3.
м3.
3.2
 ,
кДж/моль;
(2.8)
,
кДж/моль;
(2.8)
12кгС+36кгН2О=44кгСО2+4кг.Н2;
 моль;
(2.9)
моль;
(2.9)
 моль;
моль;
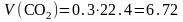 м3;
м3;
 моль;
моль;
 м3.
м3.
3.3
 , кДж/моль;
(2.10)
, кДж/моль;
(2.10)
12кгС+4кгН2=16СН4;
 моль;
(2.11)
моль;
(2.11)
 моль;
моль;
 м3.
м3.
Следующие реакции протекают в газовом объёме и являются гомогенными, считаем по объёму [10].
4
 ,
кДж/моль; (2.12)
,
кДж/моль; (2.12)
 ;
(2.13)
;
(2.13)
 м3;
м3;
 м3;
(2.15)
м3;
(2.15)
 .
.
4.1
 КДж/моль;
(2.16)
КДж/моль;
(2.16)
 м3;
м3;
 м3;
(2.17)
м3;
(2.17)
 м3.
м3.
4.2
 КДж/моль;
(2.18)
КДж/моль;
(2.18)
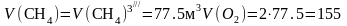 м3;
м3;
 м3.
м3.
4.3
 КДж/моль;
(2.19)
КДж/моль;
(2.19)
 м3;
м3;
 м3.
м3.
При использовании для горения кислорода воздуха необходимо учесть, что воздух представляет смесь, состоящую по объёму приблизительно из 21% кислорода (О2) и 79% азота (N2), то есть в воздухе содержится на 1 объём кислорода 79:21 = 3,76 объёма азота, или на 1 моль О2 приходится 3,76 моля N2. Азот без изменения попадает в продукты горения. Поэтому баланс продуктов горения углерода в воздухе:
 ;
;
1мольС+1мольО2+3,76мольN2=1мольСО2+3,6N2;

 м3;
м3;
 ;
;
 м3.
м3.
В результате комплексной переработки твердого топлива можно получать разнообразные продукты: коксовый газ, водород, метан, азот, насыщенные углеводороды, сажи, красители, искусственные волокна, бензол, нафталин, древесный уголь, пластмассы и другие продукты. Одним из перспективных направлений переработки ископаемого твердого топлива является получение жидкого топлива [10].
