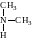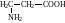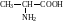Лекція 10. Аміни. Амінокислоти. Білки.
План
Загальна характеристика амінів, класифікація.
Номенклатура та ізомерія амінів
Фізичні та хімічні властивості амінів
Характеристика окремих представників амінів
Визначення, класифікація, номенклатура, ізомерія амінокислот
Фізичні та хімічні властивості амінокислот як амфотерних сполук
Способи добування амінокислот
Значення амінокислот та їх використання у сільському господарстві
Визначення, класифікація, елементарний склад білків
Просторова будова молекул білка
Фізико-хімічні властивості білків, кольорові реакції.
Значення білків у природі та використання у сільському господарстві
1. Аміни. Характеристика. Класифікація.
Аміни – похідні аміаку та гідроксиду амонію, у яких один, два або всі три атоми гідрогену заміщені вуглеводневими радикали.
Класифікація
Залежно від типу залишку розрізняють: аліфатичні аміни (насичені та ненасичені) наприклад, метиламін; ароматичні аміни – містять аміногрупу сполучену з кільцем або у бічному ланцюгу наприклад, анілін; аліциклічні; гетероциклічні аміни, наприклад амінопіридин:

2. Залежно від того, скільки атомів Гідрогену заміщено на вуглеводневі залишки (скільки залишків сполучено з атомом Нітрогену), розрізняють первинні, вторинні, третинні аміни.
|
|
|
|
аміак |
первинний амін |
вторинний амін |
третинний амін |
Первинні аміни містять аміногрупу – NH2, вторинні – іміногрупу – NH–, а третинні – третинний атом Нітрогену –N–. Відомі також сполуки з
четвертинним атомом Нітрогену –N+–
3. Залежно від кількості аміногруп – NH2 у молекулі розрізняють моноаміни, діаміни, тощо.
2. Номенклатура. Ізомерія.
За раціональною номенклатурою для утворення назви аміну перераховують вуглеводневі залишки, сполучені з атомом Нітрогену, додаючи в кінці слово «амін». За номенклатурою IUPAC аміни розглядають як аміно- (алкіламіно- чи діалкіламіно) похідні відповідних вуглеводнів. Діаміни за раціональною номенклатурою називають як відповідні двовалентні вуглеводневі залишки, додаючи закінчення –діамін. Діаміни з нерозгалудженим карбоновим ланцюгом здебільшого називають поліетилендіамінами. Для деяких амінів, особливо похідних ароматичного ряду і діамінів, широко використовують тривіальні назви. Для ароматичних амыныв тривіальні назви утворюють додаванням до слова «бензол» префікс аміно-.
Таблиця 1. Номенклатура деяких амінів
№ |
Формула |
Назва |
1. |
СН3–NH2 |
Метиламін (р.), амінометан (с.) |
2. |
СН3–NH–CH3 |
Диметиламін (р.), N-метиламінометан (с.) |
3. |
СН3–N–CH3 CH3 |
Триметиламін (р.), N, N-диметиламінометан (с.) |
4. |
СН3–СН2–NH2 |
Етиламін (р.), аміноетан (с.) |
5. |
СН3–(СН2)2–NH2 |
Пропіламін (р.), 1-амінопропан (с.) |
6. |
СН3–СН–NH2 СН3 |
Ізопропіламін (р.) 2-амінопропан (с.) |
7. |
Н2N–(CH2)2–NH2 |
Етилендіамін (р.), 1,2-діаміноетан (с.) |
8. |
Н2N–(CH2)4–NH2 |
Путресцин (т.), тетраметилендіамін (р.), 1,4-двамінобутан (с.) |
9. |
Н2N–(CH2)5–NH2 |
Кадаверин (т.), пентаметилендіамін (р.), 1,5-діамінопентан (с.) |
10. |
Н2N–(CH2)6–NH2 |
Гексаметилендіамін (р.), 1,6-діаміногексан (с.) |
11. |
|
Циклогексиламін (р.) |
12. |
|
Анілін (т.), феніламін (р.), амінобензен (с.) |
13. |
|
Метиланілін (р.), N-метиламінобензен (с.) |
14. |
|
О-толуїдин (т.), 2-амінотолуен (р.), 1-аміно-2метилбензен |
15. |
|
п-фенілендіамін (р.), 1,4-діамінобензен (с.) |
Ізомерія амінів залежить від: 1) ізомерії радикалів, 2) місцеположення аміногрупи, 3) наявності у молекулі аміну кількох різних радикалів (метамерія). Так, диметиламін (CH3)2NH метамерний (ізомерний) етиламіну СН3СН2NН2.
Способи добування. 1. Добування з галогенопохідних вуглеводнів і аміаку (реакція Гофмана). Аміак, приєднуючи молекулу галогеноводню, утворює амонійну сіль галогеноводневої кислоти:
 .
.
Подібно до цього при взаємодії аміаку з галогеналкілом утворюється сіль первинного аміну:

З надлишком аміаку частково утворюється і вільний первинний амін:

який, приєднуючи молекулу галогеналкілу, утворює сіль вторинного аміну:
 .
.
При дальшій дії аміаку утворюється вторинний амін:
 .
.
Аналогічно утворюється третинний амін:
 ,
,
 .
.
До одержаного третинного аміну може приєднатися нова молекула галогеналкілу, утворюючи сіль чотиризаміщеного амонію, яка вже не розкладається аміаком. Як бачимо, при дії аміаку на галогеналкіли утворюється суміш солей всіх чотирьох амонієвих основ. Одержану суміш піддають розкладу. Таким чином, користуючись цим способом, можна добувати первинні, вторинні й третинні аміни.
2. Добування з амідів кислот (перегрупування Гофмана). Первинні аміни, як установив у 1881 p. Гофман, можна добувати нагріванням амідів кислот з лужними розчинами хлорноватистих або бромноватистих солей:
 .
.
3. Відновлення нітробензену та його гомологів (реакція Зініна). Ця реакція є промисловим методом добування аніліну. При відновленні нітросполук нітрогрупа – NO2 перетворюється на аміногрупу – NH2, при цьому утворюються первинні аміни. Як відновники найчастіше застосовуються метали: олово, цинк або залізо у присутності хлоридної кислоти. Вперше реакція була проведена так:
C6H5NO2 + 3(NH4)2S → C6H5NH2 + 3S + 6NH3 + 2H2O
Нині як відновники застосовуються залізні друзки за наявності розчину FeCl3:
4C6H5NO2 + 9Fe + 4H2O → 4C6H5NH2 + 3Fe3O4
Ще більшого поширення набуває перспективний контактний спосіб – пропускання суміші парів нітробензену і водню над каталізатором (Сu/SiO2):
C6H5NO2 + 3H2 → C6H5NH2 + H2O
4. Відновлення нітрогенвмісних сполук. Первинні аміни можна добувати відновленням нітрилів та оксимів:
 .
.
R–CH=N–OH + 4H → R–CH2–NH2 + H2O
Оксим
Вторинні аміни можна добути відновленням ізонітрилів:
R–N=C + 4H → R–NH–CH3
5. Взаємодія спиртів з аміаком. Застосовують для синтезу лише нижчих алкіламінів (С1–С4). Сучасний промисловий метод добування первинних, вторинних і третинних амінів аліфатичного ряду полягає у взаємодії спиртів з аміаком над оксидом алюмінію або торію при температурі близько 300°С:
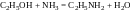 ,
,
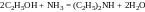 ,
,
 .
.
6. Добування первинних амінів. Найбільш зручний метод добування чистих первинних амінів зводиться до алкілування фталіміду калію з наступним омиленням продукту реакції (реакція Габріеля):
 .
.
7. Декарбоксилювання амінокислот: амінокислоти є продуктом розщеплення білків.

3. Фізичні властивості. Аліфатичні найпростіші аміни: метиламін, диметиламін і триметиламін – горючі безбарвні гази, середні члени ряду – рідини, що мають запах амоніаку і добре розчиняються у воді. Зі збільшенням молекулярної маси розчинність зменшується і підвищується температура кипіння амінів. Аміни, що містять у молекулі більше трьох атомів Карбону, мають неприємний запах зіпсованої риби.Вищі аміни є твердими речовинами, без запаху. Ароматичні аміни є рідинами або твердими речовинами з неприємним запахом. Як правило, вони мають сильну фізіологічну дію – є отруйними для людини.
Електронна та просторова будова
З п’яти електронів своєї зовнішньої оболонки атом Нітрогену витрачає три електрони на утворення ковалентних зв’язків і, крім того, має вільну пару електронів.
В молекулах аліфатичних амінів атом Нітрогену є sp3-гібридизованим, тобто молекули мають конфігурацію сплющеної піраміди, у кутах якої розміщені вуглеводневі залишки, а у вершині має бути неподілена електронна пара атома Нітрогену. Значення валентного кута атома Нітрогену становить приблизно 110°.
У молекулар ароматичних амінів атом Нітрогену перебуває в sp2-гібридизованому стані. Валентні кути становлять приблизно 120°. Отже, використовуючи дві гібридизовані орбіталі на утворення зв’язків з атомами Гідрогену аміногрупи (або з атомами Карбону залишків алкіл- або діалкіламіногрупи), а третю – на зв'язок з атомом Карбону ароматичного кільця, атом Нітрогену має ще неподілену електронну пару. При цьому завдяки плоскій конфігурації аміногрупи стає можливою р-π-кон’югація вільного електрона Нітрогену з π-електронною системою ароматичного кільця. В ароматичних амінах на аміногрупу значною мірою впливає ароматичне кільце, а саме наявність у ньому електронодонорних або електроноакцепторних замісників, особливо в орто- і пара-положеннях.
Хімічні властивості. 1. Основно-кислотні властивості. Як органічні похідні аміаку аміни мають основні властивості. При цьому аміни жирного ряду у водних розчинах є більш сильними основами, ніж аміак. При переході від первинного до третинного аміну електронна густина на атомі Нітрогену зростає під впливом алкільних груп, а отже третинні аміни мають більш сильно виражені основні властивості ніж первинні. Третинні аміни є слабкішими основами ніж вторинні
Основність амінів пояснюється здатністю атома нітрогену з неподіленої електронної пари до приєднання протона з утворенням іона заміщеного амонію. Гідроксиди амінів нестійкі, як і гідроксид амонію, і при нагріванні повністю розпадаються з утворенням вільного аміну.
У ароматичних амінів за рахунок р-π-кон’югації основні властивості виражені занчно слабкіше, ніж у аліфатичних амінів і в амоніаку, оскільки феніл має електроноакцепторний характер і зменшує електронну густину на атомі Нітрогену, послаблюючи його основні властивості. Заміна атомів Гідрогену в аміногрупі анілін на алкільні групидещо підвищує основність, але не до рівня аліфатичних амінів. Наявність в ароматичному кільці електроноакцепторних замісників приводить до зменшення, а електронодонорних – навпаки, до збільшення основності. Особливо сильний вплив зумовлюють замісники в орто- та пара-положеннях до аміногрупи.
Аміни виявляють основні властивості в реакціях з мінеральними кислотами, утворюючи алкіламонієві солі:
R–NH2 + HCl → [R–NH3]+Cl-
Під дією сильних основ з цих солей добувають вільні аміни:
[R–NH3]+Cl- + NaOH → R–NH2 + NaCl + H2O
У молекулах первинних та вторинних аліфатичних амінів унаслідок зміщення електронної густини зв’язку Nσ-←Hσ+ до атома Нітрогену атом Гідрогену частково протонізується і може виявляти слабкі кислотні властивості. Вони полягають у тому, що первинні та вторинні аміни взаємодіють зі сполуками лужного характеру, утворюючи солеподібні сполуки – алкіл- і діалкіламіди:
R–NH2 + Na → R–NH–Na + ½ H2
R–NH–Na + HOH → R–NH2 + ½ H2
2. Взаємодія з водою. Аміни розчиняються у воді, утворюючи йон алкіламонію, що супроводжується появою у розчині гідроксид-іонів:

Внаслідок цього водні розчини амінів змінюють колір індикаторів: фенолфталеїну – на малиновий, лакмусу – на синій.
3.Реакція з галогеналкілами. Третинні аміни при дії на них галогеналкілів утворюють солі, які за своєю будовою нагадують хлористий амоній:
(СН3)3N + CH3Cl = [(CH3)2–N+–(CH3)2]Cl-.
4. Ацилювання. Первинні й вторинні аміни взаємодіють з карбоновими кислотами, ангідридами кислот і галогенангідридами органічних кислот, утворюючи ацильні похідні амінів, наприклад:
 ,
,
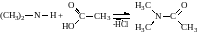 .
.
Третинні аміни в реакцію ацилювання не вступають.
5. Реакція з азотистою кислотою дає можливість розрізняти І, ІІ й ІІІ аміни. Нітритна кислота у вільному стані не існує, тому її добувають безпосередньо в реакційній суміші під дією деякого надлишку мінеральної кислоти на нітрит натрію.
а) При дії азотистої кислоти на первинні аміни відбувається виділення вільного азоту й утворення спиртів:
 .
.
Первинні аміни ароматичного ряду за цих самих умов утворюють високореакційні солі арилдіазонію:
С6Н5NH2 + O=N–OH + HCl → [C6H5–N≡N]+Cl- + 2H2O
б) Вторинні аміни, реагуючи з азотистою кислотою, виділяють воду і утворюють нітрозаміни – нейтральні речовини, які погано розчиняються у воді:
 .
.
При дії концентрованих мінеральних кислот нітрозаміни знову утворюють вихідні аміни.
в) Третинні аміни з азотистою кислотою на холоді не реагують, а при нагріванні утворюють лише нестійкі солі, що розщеплюються з утворенням складної суміші речовин, у тому числі оксосполук:

В ароматичному кільці молекул третинних ароматичних амінів відбувається звичайне електрофільне заміщення Гідрогену на нітрозогрупу, яка спрямовується аміногрупою переважно в пара-положення, а якщо воно зайняте, то в орто-положення.
6.Утворення ізонітрилів. При нагріванні первинного аміну з хлороформом і спиртовим розчином лугу утворюється ізонітрил:
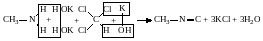 .
.
Ізонітрили мають огидний запах, і це використовують для відкриття первинних амінів.
7. Горіння. Аміни горять на повітрі, на відміну від аміаку:
![]()
Ароматичні аміни, крім зазначених реакцій, можуть вступати також у реакції, характерні для ароматичного кільця.
8. Реакції заміщення в ароматичних амінах.
Широке практичне застосування має сульфування аніліну та його гомологів, що приводить до утворення анілінсульфокислот. Особливо важливими з них є п-анілінсульфокислота (4-амінобензен-1-сульфокислота, сульфанілова кислота):

Ця кислота є основою препаратів, що застосовуються для лікування стрептококових та пневмококових захворювань – так званих сульфамідних, чи сульфаніламідних препаратів – похідних п-амінобензенсульфаміду, відомого під назвою білого стрептоциду:

До них належать дисульфан, сульфазол, норсульфазол, сульфадимезин тощо.
Галогенування ароматичних амінів
Ароматичні аміни вступають у реакції заміщення водню бензольного ядра на галоген. Реакція взаємодії аніліну з бромом використовують для якісного та кількісного визначення брому в органічних речовинах (триброманілін випадає в осад).
9. Взаємодія ароматичних амінів з альдегідами – утворення шиффових основ. Реакція відбувається при слабкому нагріванні:
С6Н5–NH2 + O=C–C6H5 → C6H5–N=CH–C6H5
анілін H дифенілазометин (бензиліденанілін)
бензальдегід
Азометини – кристалічні сполуки, що мають азометинове угруповання ––N=CH–, легко гідролізують, вилучаючи вільні ароматичні аміни, тому їх часто використовують для захисту аміногрупи.
10. Окиснення. Група NH2, як і гідроксил у молекулах фенолів, спричинює легку окиснюваність бензенового кільця в анілінах. При цьому утворюються хінони.

Повільне окиснення аніліну або його солей відбувається вже на повітрі, а також під дією білильного вапна або хромової кислоти. При цьому утворюються забарвлені речовини, які поступово темнішають, у результаті даючи барвник – аніліновий чорний. Взагалі поява фіалкового забарвлення з хлорним вапном і темно-зеленого з хромовою кислотою є якісною реакцією на анілін.
11. Ацилювання ароматичних амінів
Ацилюючими агентами є ангідриди карбонових кислот або галогенангідриди. Продукти ацилювання називають анілідами. Наприклад, одержання ацетаніліду – лікарського препарату, що використовується як жарознижувальний засіб. Одержують з аніліну та хлорангідриду оцтової кислоти.

Алкілування ароматичних амінів.
Ця реакція дає можливість з первинних амінів одержати вторинні, а з вторинних – третинні. Третинні аміни також піддаються алкілуванню, при цьому утворюються четвертинні амонійні солі (реакція Гофмана).

Дія азотистої кислоти на ароматичні аміни
А) солі первинних амінів при взаємодії з азотистою кислотою перетворюються в азосполуки, що використовуються для синтезу багатьох барвників та медикаментів:

Б) вторинні і жирно-ароматичні аміни – утворюють нітрозоаміни – вихідні речовини для синтезу багатьох лікарських препаратів:
В) третинні ароматичні аміни направляють нітрозогрупу у п-положення відносно аміногрупи, так як яміногрупа є орієнтантом І роду:

4.Окремі представники.
Метиламін CH3NH2 утворюється при розкладанні білків, деяких алкалоїдів. У промисловості його добувають нагріванням суміші формаліну з хлористим амонієм. Метиламін являє собою горючий газ з різким нудотним запахом. Застосовується при виготовленні фармацевтичних препаратів, фунгіцидів, інсектицидів, прискорювачів вулканізації каучуку, ПАР, алкалоїдів груп тропану й барвників антрахінонового ряду.
Диметиламін (CH3)2NH міститься разом з триметиламіном в оселедцевому розсолі та в тухлих оселедцях.
Найбільш простий спосіб добування диметиламіну (в суміші з метил і триметиламіном) полягає у взаємодії метилового спирту з аміаком під тиском у газовій фазі над каталізатором типу глинозему.
Диметиламін являє собою газ з різким неприємним запахом, легко скраплюється при охолодженні або під тиском у безбарвну рідину. Застосовується для добування тетраметилтіурамідсульфіду – прискорювача процесу вулканізації каучуку, а також використовується при добуванні дуже ефективної лікарської речовини – аміназину.
Триметиламін (CH3)3N міститься в оселедцевому розсолі, тухлих оселедцях і квітах деяких рослин, надаючи їм неприємного запаху. Триметиламін являє собою газоподібну речовину. В концентрованому стані має запах, дуже схожий на запах аміаку, а в невеликих концентраціях запах гнилої риби. Використовують при синтезі четвертинних сполук (бактерицидів), кормових домішок. З четвертинних основ та їх солей найбільше значення має хлорид триметилдодециламонію. Ця сполука використовується як детергент, що має бактерицидні властивості («катіонне мило»), сировина для органічного синтезу.
Діетиламін (C2H5)2NH – безбарвна рідина з різким запахом. У промисловості добувають при взаємодії етилового спирту з аміаком при 300 – 450°С і лід тиском 15–30 ат. Застосовується діетиламін як проміжний продукт у виробництві багатьох лікарських речовин, наприклад кардіаміну, новокаїну та ін., а також для добування дисульфідтетраетилураму – прискорювача вулканізації каучуку.
Гексаметилендіамін, або 1,6-діаміногексан, H2N(CH2)6NH2 – тверда кристалічна речовина з температурою плавлення 42°С. Добувають у промисловості з адипінової кислоти. В останній час гексаметилендіамін набув великого практичного значення як вихідний матеріал для виробництва поліамідних смол. При взаємодії з фосгеном гексаметилендіамін утворює гексаметилендіізоціанат. Останній з гліколями утворює поліуретани. Поліуретани застосовуються для виготовлення клеїв, синтетичних волокон, пластичних мас, антикорозійних лаків і т.д.
Поліамідні смоли (поліаміди). Поліамідні смоли є продуктами поліконденсації амінокислот або двоосновних карбонових кислот з діамінами, а також продуктами полімеризації лактамів амінокислот. Окремі ланки сполучені амідними групами –NH–CO–, звідки походять їх назва – поліаміди. Близько половини всієї кількості синтетичних волокон виготовляється з поліамідних смол. Найбільше поширення в промисловості набули два типи поліамідних смол – капрон і найлон.
Капрон. Капрон добувається з полімеру капролактаму. Вихідною сировиною для добування полікапролактаму є лактам 2-амінокапронової кислоти – капролактам. Полімеризацію капролактаму провадять при температурі 240 – 260°С і 15 – 16 ат. в атмосфері азоту в присутності води (5 – 10%) і оцтової кислоти (0,5 – 1%). Вода відіграє роль активатору реакції полімеризації капролактаму, а оцтова кислота – стабілізатора цього процесу, знижує або регулює питому масу полімеру.
Після закінчення полімеризації розплавлений поліамід витікає з автоклаву й застигає у вигляді вузької стрічки. Цю стрічку подрібнюють, обробляють гарячою водою для видалення низькомолекулярних домішок і висушують. Висушений подрібнений полікапролактам використовується для формування капрону. Капрон дуже цінний своєю високою стійкістю до стирання, високою міцністю до розриву, еластичністю й стійкістю до дії лугів. Капрон широко застосовується для виготовлення технічних тканин (фільтрувальних, кордних та ін.), рибальських снастей і товарів широкого вжитку – трикотажу, панчох, тканин.
Волокно анід (найлон). Смола анід, що використовується для формування волокна добувається шляхом конденсації солі АГ (сіль адипінової кислоти і гексаметилендіаміну) в автоклаві при температурі 270 – 280°С в атмосфері азоту в присутності стабілізатора (моноамінів або одноосновної карбонової кислоти). Добуту розплавлену смолу після ретельної відгонки води в вакуумі продавлюють крізь щілинний отвір у жолоб, заповнений водою, температура якої 10 – 12°С. Застиглу смолу висушують, подрібнюють, плавлять і з плаву одержують анідне волокно. Фізико-механічні показники аніду аналогічні показникам капрону. Так само як і капрон, анід має велику міцність до розриву, стійкість до багаторазової деформації і низьку гідрофільність. Тому він широко використовується в техніці.
Волокно енант. Смола енант з розплаву якої провадиться формування волокна, добувається шляхом поліконденсації -аміноенантової кислоти без доступу повітря в атмосфері азоту під тиском 14 – 15 ат. при температурі 250 – 260°С. Смола енант відзначається високою термостійкістю (до 210 – 230°С), світлостійкістю і високим модулем пружності. Добуте з енанту синтетичне волокно основними фізико-механічними показниками (міцністю, подовженню стійкості до стирання, жорсткості) не поступається капроновому і найловому волокнам, а за рядом властивостей перевищує їх.
Волокно енант найбільш використовується для технічних цілей і, зокрема, для кордної промисловості, також для виробництва товарів широкого вжитку.
Кадаверин NH2–(CH2)5–NH2 – безбарвна рідина, легко розчиняється в воді та етанолі. Відноситься до трупних отрут. Міститься в продуктах гниття білків, у мухоморах, ріжках. Утворюється при ферментативному декарбоксилюванні лізину. Синтетично одержують гідруванням динітрилу глутарової кислоти.
Путресцин NH2–(CH2)4–NH2 – кристалічна речовина, легко розчинна у воді, етанолі, важче – в діетиловому ефірі. Відноситься до трупних отрут. Утворюється при декарбоксилюванні амінокислоти орнітину. Синтетично одержують шляхом гідрування динітрилу янтарної кислоти.
Кадаверин та путресцин належать до птомаїнів -органічних основ, що утворюються під час гниття тваринних продуктів.
Анілін – вязка, безбарвна рідина, що темніє на повітрі та на світлі, погано розчинна у воді, краще – в органічних розчинниках. Використовують у синтезі барвників та медикаментів.
N,N- диметилаланілін – використовується у великих кількостях для виробництва трифенілметанових барвників – малахітового зеленого, метилового фіолетового тощо.
Дифеніламін – застосовують як проміжну речовину для виготовлення синтетичних барвників та фармацевтичних препаратів.
Цикламат натрію (або кальцію) в деяких країнах застосовується як штучна підсолоджуюча речовина, але в організмі він може легко перетворюватись на канцерогенний циклогексиламін:

Бензидин (4,4-диамінодифеніл) – біла кристалічна речовина, погано розчинна у воді, краще – в етанолі та діетиловому ефір, швидко темніє на повітрі. Одержують реакцією Зініна з нітробензолу. Використовують у біохімічному аналізі як реактив для виявлення крові в біологічних рідинах (сечі, травних соках), зм’якшувач гумової суміші, як реагент для визначення сульфатів, вольфраматів, у виробництві азобарвників, в колориметричному аналізі для визначення хрому, міді, заліза, свинцю, ртуті. Бензидин – канцерогенна речовина.
5. Амінокислоти можна розглядати як похідні карбонових кислот кислот, у яких один з гідрогенових атомів у радикалі заміщений аміногрупою. Вони є гетерофункціональними сполуками, оскільки містять одночасно карбоксильну та амінну функціональну групи.
Класифікація.
За кількістю амінних і карбоксильних груп розрізняють:
А) моноаміномонокарбонові кислоти (дона аміно і одна карбоксильна група), або нейтральні амінокислоти;
Б) діаміномонокарбоновікислоти (дві аміно та одна карбоксильна групи) або основні амінокислоти;
В)Моноамінодикарбонові кислоти, або кислі амінокислоти.
2. Залежно від характеру вуглеводневого залишку амінокислоти поділяють на ароматичні, аліфатичні, гетероциклічні.
3. У залежності від положення аміногрупи відносно карбоксильної групи розрізняють -, -, - і т.д. амінокислоти, наприклад:
|
|
|
-амінопропіонова кислота |
-амінопропіонова кислота |
-аміномасляна кислота |
4. в біоорганічній хімії амінокислоти поділяють на синтетичні та природні. Серед природних, в свою чергу, розрізняють ті, що входять до складу білків (протеїногенні) та ті, що не входять до складу білків (непротеїногенні). Також розрізняють замінні амінокислоти (ті, що можуть синтезуватися в організмі) та не заміні, що не синтезуються в організмі і надходять в нього лише з їжею.
До незамінних амінокислот відносять цистеїн, метіонін, валін, треонін, лейцин, ізолейцин, аргінін, лізин, фенілаланін, триптофан. До умовно незамінних відносять гістидин, оскільки його незначна нестача у кормах поповнюється за рахунок синтезу мікрофлори травного тракту.
Амінокислоти, як і інші класи органічних речовин, утворюють гомологічний ряд, який можна записати виходячи з гомологічного ряду карбонових кислот. Для цього необхідно у радикалі карбонової кислоти замінити один або більше гідрогенових атомів на аміногрупу.
Амінокислоти мають велике значення оскільки вони входять до складу білкових речовин тваринних і рослинних організмів, деяких антибіотиків і вітамінів. Більшість природних амінокислот є -амінокислотами.
Номенклатура та ізомерія. За раціональною номенклатурою назви амінокислот утворюють від тривіальних назв карбонових кислот, додаючи слово аміно- і взаємне розміщення аміногрупи та карбоксильної групи позначають літерами грецького алфавіту, наприклад:
|
|
-амінопропіонова кислота |
-аміномасляна кислота |
За систематичною номенклатурою (IUPAC) назву амінокислоти утворюють з назви відповідного вуглеводню, до якої додають префікс аміно-, закінчення -ова і слово кислота. Місцеположення аміногрупи позначають цифрою. Нумерацію карбонового ланцюга починають з атома карбону карбоксильної групи.
2-амінопропанова кислота 3-амінобутанова кислота
Найпоширенішими для амінокислот є тривіальні назви, зумовлені їхніми характериними ознаками, властивостями або назвами продуктів, з яких вони виділені. Так, назва гліцин походить від грецького γλυκύς – солодкий, лейцин – від грец. λευκός – білий (був виділений з молочного білка), лізин – від грец. λύσις – розпад (утворюється при розкладанні практично всіх білків).
Амінокислоти, що входять до складу білків, часто позначають за допомогою скорочених назв – це перші три, рідко чотири, літери тривіальної назви кислоти.
Таблиця 2. Номенклатура деяких амінокислот
№ |
Формула |
Назва |
Укр. Умовне скорчення |
Англ. Умовне скорочення |
Протеїногенні амінокислоти Аліфатичні моноаміномонокарбонові кислоти |
||||
1. |
H2N–CH2–COOH |
Гліцин (глікокол, 2-аміноетанова кислота |
Глі |
Gli |
2. |
CH3–CH–COOH NH2 |
α-Аланін ( 2-амінопропанова кислота) |
Ала |
Аla |
3. |
CH3–CH–CH3– COOH NH2 |
Валін (3-амінобутанова кислота) |
Вал |
Val |
Ароматичні моноаміномонокарбонові кислоти |
||||
4. |
|
Фенілаланін (2-аміно-3-фенілпропанова кислота) |
Фен |
Phe |
Гетероциклічні моноаміномонокарбонові кислоти |
||||
5. |
|
Пролін (2-піролідинкарбонова кислота) |
Про |
Pro |
6. |
|
Триптофан (2-аміно-3-індолілпропанова кислота) |
Три |
Tri |
7. |
|
Гістидин (2-аміно-3-імідазолілпропанова кислота) |
Гіс |
Gis |
Моноамінодикарбонові кислоти |
||||
8. |
|
Глутамінова (2-амінопентандіова кислота) |
Глу |
Glu |
Діаміномонокарбонові кислоти |
||||
9. |
H2N–(CH2)4–CH–COOH NH2 |
Лізин (2,6-діаміногексанова кислота) |
Ліз |
Lis |
Гідрокис- і тіолоамінокислоти |
||||
10. |
HO–CH2–CH–COOH NH2 |
Cерин (2-аміно-3-гідроксипропанова кислота) |
Сер |
Ser |
11. |
HS–CH2–CH–COOH NH2 |
Цистеїн (2-аміно-3-тіопропанова кислота) |
Цис |
Сys |
Гідрокси- і тіолоамінокислоти |
||||
12. |
|
Тирозин [2-аміно-3-(4-гідроксифеніл)-пропанова кислота |
Тир |
Tyr |
Непротеїногенні амінокислоти |
||||
13. |
H2N–CH2–CH2–COOH |
β-Аланін (3-амінопропанова кислота) |
|
|
14. |
|
п-Амінобензенова кислота |
|
|
15. |
H2N–(CH2)3–CH–COOH NH2 |
Орнітин |
|
|
Ізомерія амінокислот аналогічна ізомерії оксикислот. Амінокислотам, які іншим органічним сполукам, властива ізомерія, яка для цих речовин може бути пов'язана з різним положенням аміногрупи відносно карбоксильної (наприклад, α-, β- і γ-аміномасляні кислоти), а також з розгалуженням карбонового ланцюга молекули амінокислоти. Таким ізомером α-, β- і γ-аміномасляних кислот є 2-аміно-2-метилпропанова кислота:
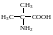
Амінокислоти, молекули яких містять асиметричні карбонові атоми, виявляють оптичну активність і існують у вигляді дзеркальних ізомерів, наприклад α-амінопропіонова кислота:

6. Способи добування. α-Амінокислоти L-ряду поширені в природі. Вони є складовими частинами білків. Амінокислоти D-ряду добувають шляхом синтезу.
Із синтетичних методів добування амінокислот найважливіші такі:
1. Мікробіологічний синтез відбувається у клітинах мікроорганізмів або поза ними під впливом ферментів, які виділяють мікроорганізми. В наш час навчилися так спрямовувати життєдіяльність деяких мікроорганізмів, що вони не нагромаджують білок, а синтезують певну амінокислоту. Отже, з нехарчової сировини (вуглеводні нафти, газоподібні вуглеводні) за допомогою мікроорганізмів добувають у промислових масштабах лізин, глутамінову кислоту та деякі інші амінокислоти.
2. Гідроліз білків. Більшість амінокислот добувають гідролізом білків. Розрізняють лужний, кислотний та ферментативний гідролізи. При цьому утворюються дуже складні суміші амінокислот. Але розроблено ряд методів (йонообмінна і газорідинна хроматографія, електрофорез), які дозволяють з цих сумішей добувати окремі амінокислоти. У промислових масштабах зазвичай гідролізують відходи м’ясної промисловості (копита, роги, кров тощо)
3. Дія надлишку аміаку на галогенозаміщені карбонові кислоти. Цим способом можна добути різноманітні амінокислоти в залежності від вихідної галогенокислоти:

4. З ціангідринів альдегідів і кетонів (реакція Штрекера). В умовах цієї реакції карбонільна сполука спочатку взаємодіє з амоніаком і утворює імін який потім приєднує ціановодень і перетворюється таким чином на нітрил α-амінокислоти. Під час гідролізу такого нітрилу добувають α-амінокислоту:
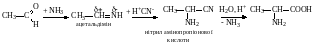
М.Д. Зелінський вдосконалив цей метод добування α-амінокислот, застосувавши в реакції замість синильної кислоти суміш калій ціаніду і амоній хлориду, які утворюють амоній ціанід.

5. Приєднання аміаку до ненасичених кислот зумовлює утворення β-амінокислот.

Це приєднання узгоджується з приєднанням до кон՚югованих систем (типу 1,3-бутадієну).
![]()

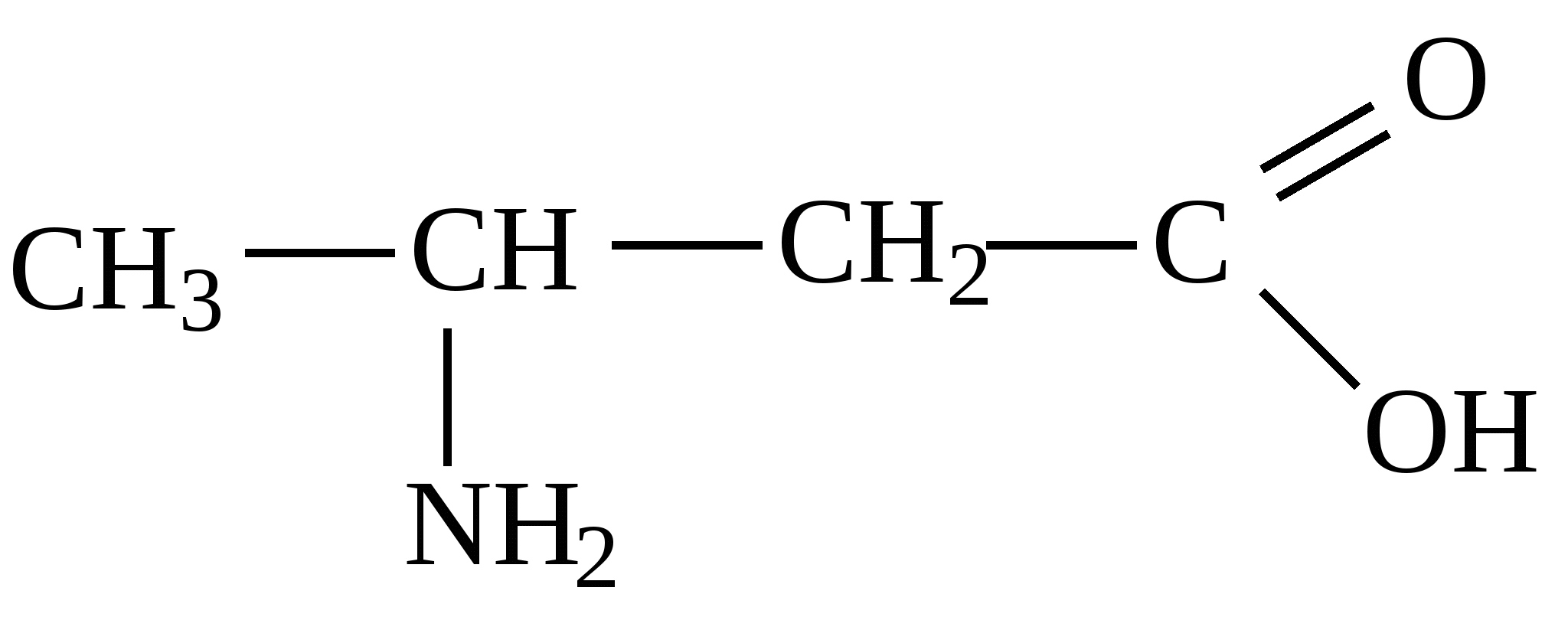
+ → +СО2 +Н2О
6. Синтез β-амінокислот конденсацією альдегідів з малоновою кислотою та аміаком (реакція Родіонова):
7. Для синтетичного добування окремих амінокислот використовують спеціальні методи. Так, ε-амінокапронову кислоту добувають, виходячи з фенолу за такою схемою:
 8.
Відновлення нітрокислот є
важливим методом синтезу ароматичних
амінокислот: О2N–C6H4–COOH
+ H2
→ H2N–C6H4–COOH
8.
Відновлення нітрокислот є
важливим методом синтезу ароматичних
амінокислот: О2N–C6H4–COOH
+ H2
→ H2N–C6H4–COOH
7.Фізичні властивості. Зумовлені особливістю існування їхніх молекул у формі біполярного іона – цвітер іона. Усі амінокислоти являють собою безбарвні кристалічні речовини, нелеткі, з високими температурами плавлення, при цьому плавлення відбувається з розкладанням. Тому температура плавлення не є характерною константою для цих речовин.
Більшість амінокислот добре розчиняються у воді, гірше – в органічних розчинниках. α-Амінокислоти L-ряду, що входять до складу білків, гіркі на смак або не мають його, а їх D-ізомери – солодкі на смак.
Хімічні властивості. Оскільки в молекулах амінокислот одночасно містяться карбоксильна і амінна групи, то ці речовини виявляють властивості як кислот, так і амінів, тобто є амфотерними сполуками. У вільному стані і в розчинах амінна та карбоксильна групи в молекулах амінокислот взаємодіють між собою.
Амінокислоти є типовими амфотерними сполуками. У кислому середовищі вони виявляють властивості основ, у лужному – кислот:
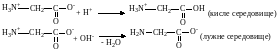
Якщо концентрації катіонів і аніонів у розчині амінокислоти однакові, то концентрація біполярного іона буде максимальною і в електричному полі він не переміщується. Такий стан амінокислоти називається її ізоелектричною точкою. Ізоелектрична точка амінокислоти характеризується певним значенням рН середовища.
1. Утворення солей. Оскільки амінокислоти мають амфотерний характер, вони можуть утворювати солі як з кислотами, так і з основами:

2. Амінокислоти взаємодіють з гідроксидами важких металів, розчиняють їх і утворюють при цьому комплексні сполуки (хелати). Так, з купрум (ІІ) гідроксидом амінокислоти утворюють забарвлені в темно-синій або синьо-фіолетовий колір комплекси:
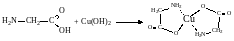
У цій солі атом купруму сполучений з атомами нітрогену координаційними (донорно-акцепторними) зв'язками.
3. Утворення складних ефірів. Амінокислоти, подібно до карбонових кислот, взаємодіють із спиртами і утворюють складні ефіри:
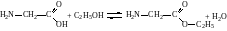
Цю реакцію використовують для розділення і виділення амінокислот з білкових гідролізатів.
4. Утворення хлорангідридів. При взаємодії амінокислот з фосфор пентахлоридом утворюються хлорангідриди:
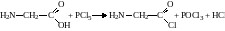 .
.
5. Реакції дезамінування (дія нітритної кислоти або ферментів дезаміназ). Під дією на амінокислоти нітритної кислоти виділяється азот аміногрупи і амінна група при цьому заміщується на гідроксогрупу. Продуктами цих реакцій є оксикислоти:

Реакція амінокислот з нітритною кислотою використовується для кількісного аналізу вмісту амінокислот (за об'ємом азоту, який виділяється, метод Ван-Слайка).
6. Ацилування амінокислот. У молекулах амінокислот, як і амінів, атом гідрогену аміногрупи може заміщуватися на залишки карбонових кислот (ацили):

7. Алкілування амінокислот. При алкілуванні амінокислот, залежно від кількості взятої алкілуючої речовини, утворюються вторинні, третинні алкіловані амінокислоти, а в кінцевому результаті – четвертинні амонійні основи, внутрішні солі яких називають бетаїнами:
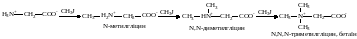
8. Перетворення амінокислот при нагріванні. Залежно від взаємного розміщення аміногрупи і карбоксильної групи амінокислоти по-різному реагують на нагрівання, що використовують для встановлення їхньої будови.
α-Амінокислоти при нагріванні відщеплюють воду (міжмолекулярно) і утворюють циклічні аміди – дикетопіперазини:

β-Амінокислоти при нагріванні відщеплюють амоніак (внутрішньомолекулярно) за рахунок аміногрупи і атома гідрогену СН2-групи, сусідньої з СООН-групою:
H2N–CH2–CH2–COOH → CH2=CH–COOH + NH3
γ-, δ- і ε-Амінокислоти при нагріванні відщеплюють воду (внутрішньомолекулярно) за рахунок зближених у просторі NH2- і СООН-груп. При цьому утворюються циклічні внутрішньомолекулярні аміди – лактами:
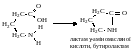
Атом гідрогену NH-групи лактамів виявляє підвищену рухливість. Внаслідок цього лактами можуть існувати як в лактамній, так і в лактимній (енольній) таутомерних формах, які зв'язані між собою рухомою рівновагою:
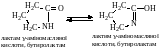
Тому лактами виявляють двоїсту властивість і можуть утворювати як N-, так і О-похідні, тобто похідні як лактамної, так і лактимної форм. Такого типу таутомерія називається лактам-лактимною.
9. Декарбоксилування амінокислот. У живих організмах α-амінокислоти піддаються різноманітним перетворенням, зокрема декарбоксилуванню. При цьому утворюються аміни, які виявляють високу біологічну активність, тому їх називають біогенними амінами. Так, при декарбоксилуванні глутамінової кислоти утворюється γ-аміномасляна кислота:
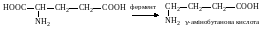
γ-Аміномасляна кислота міститься в мозковій тканині і виконує в організмі функції нейрогуморального інгібітора.
Біогенні аміни утворюються також при декарбоксилуванні таких амінокислот білків, як аспарагінова кислота, тирозин, триптофан, гістидин та ряду інших.
10. Утворення пептидів.
Молекули α-амінокислот при особливих умовах можуть вступати в реакцію між собою, утворюючи сполуки, в яких залишки амінокислот з’єднуються між собою пептидним зв’язком СО–NH– пептиди. Наприклад, з двох молекул амінокислот за рахунок карбоксилу однієї молекули та аміногрупи іншої молекули утворюється дипептид:

11. Нінгідринова реакція
Є специфічною реакцією і дає можливість виявити кількісно дуже невеликі концентрації амінокислот. На першій стадії утворюється гідриндантин, який з надлишком нінгідрину дає комплексну сполуку синьо-фіолетового кольору.