
- •Лекція 2. Насичені вуглеводні та їх похідні
- •2. Ізомерія. Номенклатура. Структурна ізомерія насичених вуглеводнів починається з бутану. Бутан існує у вигляді двох, пентан – у вигляді трьох ізомерів. Наприклад:
- •Крім того для насичених вуглеводнів характерна ізомерія положення замісників.
- •1. У молекулі вуглеводню вибирають основний – найдовший і найскладніший (який має найбільше число відгалужень) – карбоновий ланцюг:
- •3. Способи добування.
- •4. Фізичні та хімічні властивості.
- •5. Застосування
3. Способи добування.
Основними джерелами алканів є нафта та супутній природний газ. Природний газ містить тільки леткі алкани, тобто алкани з низькою молекулярною масою, і складається здебільшого з метану, значно меншої кількості етану, пропану та вищих алканів.
Фракційною перегонкою нафти добувають різні фракції. Кожна фракція є складною сумішшю алканів з різною кількістю атомів Карбону. Виділення індивідуальних сполук зі збільшенням у них кількості атомів Карбону стає все складнішим завданням, оскільки зростає кількість ізомерних сполук і зменшується різниця в їх фізичних властивостях. Тому застосовують синтетичні методи добування алканів. Найважливіші з них такі:
1. Гідрування ненасичених вуглеводнів. Насичені вуглеводні можна добути з ненасичених, тобто таких, що містять подвійні або потрійні зв’язки, приєднуючи до останніх Гідроген. Цю реакцію, яка називається – гідруванням, або гідрогенізацією, провадять у присутності каталізаторів (Рt, Рd, Nі, Сu, NіО та ін.):

Метод гідрування ненасичених вуглеводнів широко застосовується для синтезу розгалужених алканів, у тому числі тих, які містять четвертинні атоми Карбону.
2. Відновлення галогенопохідних. Відновлення галогенопохідних насичених вуглеводнів гідрогеном за наявності каталізатора, атомами Гідрогену в момент виділення або гідроген йодидом:

 .
.
3. Реакція Вюрца. З синтетичних способів добування насичених вуглеводнів найбільше значення має дія металічного натрію на галогеналкіли (реакція Вюрца):
 .
.
4. Електроліз водних розчинів солей карбонових кислот (синтез Кольбе). Кольбе, а згодом інші дослідники показали, що при електролізі водних розчинів одноосновних насичених карбонових кислот або їх лужних солей утворюються насичені вуглеводні:
 .
.
5. Сплавляння солей карбонових кислот з лугами (синтез Дюма). При сплавлянні солей карбонових кислот з лугами або натронним вапном (суміші Са(ОН)2 і NаОН) відбувається їх декарбоксилування і одночасно утворюються насичені вуглеводні:
 .
.
6 Гідрування оксиду карбону. У 1902 р. П. Сабатьє пропускаючи суміш оксиду карбону й гідрогену в об’ємному співвідношенні 1:3 над подрібненим нікелем, одержав найпростіший вуглеводень метан:
 .
.
7. Дія води на карбід алюмінію.
 .
.
Гідроліз реактивів Гріньяра.
Якщо додати розчин алкілгалогеніду в сухому діетиловому етері до металічного Магнію і перемішати, то відбувається бурхлива реакція. Розчин каламутніє, починає кипіти, а металічний Магній поступово розчиняється. Утворений розчин отримав назву реактиву Гріньяра. Це один з найважливіших органічних реагентів.
СН3І + Mg → CH3MgI
CH3MgI + HOH → CH4 + Mg(OH)I
Використання реактиву Гріньяра зумовлене його високою реакційною здатністю. Він активно реагує з різними неорганічними сполуками, в тому числі з водою, вуглекислим газом, киснем і великою кількістю органічних сполук.
4. Фізичні та хімічні властивості.
Перші чотири насичених вуглеводнів, тобто метан, етан, пропан, бутан, є газами, наступні – рідинами, починаючи з С16Н34 – твердими тілами. Зі зростанням кількості атомів Карбону в молекулі нормальних насичених вуглеводнів закономірно підвищуються точки плавлення і точки кипіння, а також збільшується питома маса вуглеводнів.
Температура кипіння вуглеводнів з розгалуженим ланцюгом нижча, ніж температура кипіння відповідних сполук з нормальним ланцюгом, при тому тим нижча, чим більше розгалужений вуглецевий ланцюг молекули. Навпаки, температура плавлення тим вища, чим більше розгалужений вуглецевий ланцюг.
Перші представники цього класу сполук – метан і етан – не мають запаху; леткі рідкі вуглеводні мають характерний запах бензину; тверді мало леткі вуглеводні також не мають запаху.
Насичені вуглеводні легші за воду і практично нерозчинні в ній; розчиняються в звичайних органічних розчинниках. Зі збільшенням молекулярної маси розчинність зменшується. Густина зростає зі збільшенням розміру алканів, але має межу 0,8.
Хімічні властивості. Вуглеводні ряду метану за звичайних умов мало активні. Ці вуглеводні нездатні до реакцій приєднання, тому що валентні зв'язки атомів Карбону цілком насичені Гідрогеном.
Хімічні реакції насичених вуглеводнів можуть відбуватися за рахунок розриву зв’язків С – С або С – Н. Розрив С – Н зв’язків супроводжується відщепленням атомів Гідрогену з утворенням ненасичених сполук або подальшим заміщенням відщеплених атомів Гідрогену іншими атомами чи групами атомів.
Залежно від будови алкану і умов реакції в молекулах насичених вуглеводнів зв’язок С – Н може розриватися гомолітично:

і гетеролітично:

 .
.
При цьому утворюються вільні радикали, що мають неспарений електрон, але не мають електричного заряду.
Насичені вуглеводні важко окислюються, важко сульфуються і нітруються. Однак вони легко вступають у взаємодію з хлором і бромом, утворюючи суміші галогенопохідних насичених вуглеводнів.
Реакція з галогенами. Насичені вуглеводні порівняно легко вступають в реакції заміщення з галогенами, особливо на світлі. При цьому атоми Гідрогену послідовно заміщуються атомами галогену. Швидкість галогенування алканів різко зменшується в ряду: F>Cl>Br>I. Реакція з вільним флуором супроводжується вибухом і руйнуванням молекул вуглеводню:

Розбавляння флуору нітрогеном дає можливість добувати поліфторпохідні алканів з досить високим виходом:
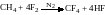 .
.
Реакція метану з хлором відбувається дуже бурхливо і звичайно приводить до утворення суміші моно- і полігалогенідів. Вищі алкани хлоруються більш спокійно.
 .
.
При взаємодії хлору з насиченими вуглеводнями молекула хлору насамперед дисоціює на атоми, які потім взаємодіють з вуглеводнем; при цьому утворюється вільний радикал і виділяється гідроген хлорид. Вуглеводневий радикал, реагуючи з іншою молекулою хлору, утворює хлорпохідне вуглеводню, при цьому один атом хлору звільняється. Таким чином, хлорування насичених вуглеводнів – типовий радикальний процес.
Обрив реакційного ланцюга відбувається внаслідок рекомбінації атомів хлору або внаслідок реакції між атомом хлору і вуглеводневим радикалом.
Дія нітратної кислоти. Концентрована нітратна кислота при звичайній температурі не діє на насичені вуглеводні, при нагріванні має окислюючу дію.
Однак, як встановив М.І. Коновалов (1883), розведена нітратна кислота при нагріванні і під підвищеним тиском реагує з насиченими вуглеводнями з утворенням нітросполук:
 .
.
Дія сульфатної кислоти (реакція сульфування). Концентрована сульфатна кислота при звичайній температурі не діє на насичені вуглеводні. Цю властивість алканів використовують у нафтовій промисловості для хімічної очистки нафтопродуктів. При слабкому нагріванні димуча сульфатна кислота може сульфувати насичені вуглеводні, зокрема, якщо вони містять третинний атом Карбону:
 .
.
Сульфохлорування. При взаємодії алканів з сульфур диоксидом і хлором добувають алкансульфохлориди – хлорангідриди сульфокислот насичених вуглеводнів:

Реакція сульфохлорування відбувається в присутності каталізатора або під впливом ультрафіолетових променів і має радикально-ланцюговий характер. У промислових масштабах сульфохлорування застосовується головним чином для виробництва миючих засобів.
Сульфоокислення. При обробці алканів нормальної будови сумішшю сульфур діоксиду і Оксигену утворюються сульфокислоти. Цей процес, який називається сульфоокисленням, його можна провадити фотохімічно, освітлюючи реакційну суміш ультрафіолетовими променями або каталітично (каталізатор – оцтовий ангідрид):
 .
.
Дегідрування алканів при високих температурах. Під дією високих температур насичені вуглеводні або зазнають дегідрогенізації (О.О. Баландін), наприклад:
 .
.
Крекінг алканів. При нагріванні насичених вуглеводнів до температури понад 400 оС відбуваються перетворення, які супроводжуються розривом С – С зв’язків у молекулах. Як приклад розглянемо крекінг бутану при атмосферному тиску і 600 оС, в результаті якого утворюється суміш метану, етану, етилену, пропілену, бутилену і Гідрогену:


 .
.
Крекінг (від англ. to crack – розщеплювати) вперше здійснив О.О. Летній, а В.Г. Шухов у 1891 році взяв перший патент на установку крекінга. Цей процес має промислове застосування. За допомогою крекінгу з високо киплячих нафтових фракцій (гас, солярове масло, мазут) одержують низько киплячі і таким чином вихід бензину із сирої нафти майже у три рази. Основні процеси, які відбувають при крекінгу, – це дегідрогенізація алканів і розрив С – С зв’язків їх молекул. Одночасно відбуваються також реакції ізомеризації та циклізації молекул насичених вуглеводнів.
Якщо термічний розклад алканів провадять без каталізаторів при температурі 700 – 800 оС і вище, то такий процес називають піролізом. При піролізі алканів відбуваються більш глибокі зміни в їхніх молекулах, аж до утворення Карбону (сажі і коксу).
Окислення. Окислювачі, навіть такі, як хромова суміш, перманганат калію, нітратна кислота, при звичайній температурі не діють на насичені вуглеводні з нормальним вуглецевим ланцюгом. При підвищеній температурі сильні окислювачі окислюють насичені вуглеводні, внаслідок чого утворюються оксигеновмісні речовини з меншою кількістю атомів Карбону, ніж вихідний вуглеводень; отже, при цьому відбувається не лише окислення, але й розщеплення молекул вуглеводню.
Шляхом окислення газоподібних вуглеводнів С1–С4 Оксигеном або повітрям одержують суміші спиртів, альдегідів, кетонів і карбонових кислот аліфатичного ряду, які містять не більше чотирьох Карбонових атомів. Таким способом одержують метиловий спирт, формальдегід, оцтовий альдегід, оцтову кислоту, ацетон і первинні бутилові спирти.
Окисленням повітрям рідких і твердих алканів (переважно суміші твердих вуглеводнів С16–С30, яку називають парафіном) добувають карбонові кислоти з кількістю карбонових атомів у молекулі від 10 до 20, які придатні для виготовлення господарського й туалетного мила, мастил, технічних миючих засобів, плівкоутворюючих речовин і т.д.
Горіння.
Алкани горять голубим полум’ям, при достатньому доступі кисню, з виділенням великої кількості теплоти. Це дозволяє їх використовувати як висококалорійне паливо.
СН4 + 2О2 → СО2 + 2Н2О + 890 кДж/моль
Ізомеризація алканів. Насичені вуглеводні нормальної будови при температурі 100 °С і наявності каталізатора (AlCl3) ізомеризуються в алкани з розгалуженою будовою. Так, пентан за цих умов ізомеризується в ізопентан.

