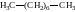- •Лекція 2. Насичені вуглеводні та їх похідні
- •2. Ізомерія. Номенклатура. Структурна ізомерія насичених вуглеводнів починається з бутану. Бутан існує у вигляді двох, пентан – у вигляді трьох ізомерів. Наприклад:
- •Крім того для насичених вуглеводнів характерна ізомерія положення замісників.
- •1. У молекулі вуглеводню вибирають основний – найдовший і найскладніший (який має найбільше число відгалужень) – карбоновий ланцюг:
- •3. Способи добування.
- •4. Фізичні та хімічні властивості.
- •5. Застосування
Лекція 2. Насичені вуглеводні та їх похідні
План
Загальна характеристика класу.
Номенклатура. Ізомерія.
Способи добування.
Фізичні та хімічні властивості.
Застосування.
Поширення в природі. Нафта. Походження та класифікація нафти.
Найпростіші органічні сполуки, які складаються з Карбону і Гідрогену, називаються вуглеводнями. Вуглеводні, які мають відкритий ланцюг карбонових атомів, називаються аліфатичними, або вуглеводнями жирного ряду. Численна група аліфатичних вуглеводнів поділяється на дві підгрупи: 1) насичені, або граничні, вуглеводні; 2) ненасичені, або неграничні, вуглеводні, які містять подвійні чи потрійні зв’язки.
Насичені вуглеводні (алкани, парафіни) – вуглеводні, атоми Карбону в молекулах яких сполучені між собою простими (одинарними) -зв’язками. Всі інші одиниці валентності атомів Карбону в цих сполуках зайняті (насичені) атомами Гідрогену. Атоми Карбону в молекулах насичених вуглеводнів перебувають у першому валентному стані, тобто в стані sp3-гібридизації. Парафінами ці органічні сполуки називають тому, що довгий час їх вважали малореакційноздатними. Стара назва насичених вуглеводнів – аліфатичні, або жирні, вуглеводні (від лат. alifatic – жирний). Ця назва походить від назви перших вивчених сполук, які колись відносили до цих речовин, – жирів. Загальна формула алканів – СnH2n+2.
Найпростішим представником насичених вуглеводнів є метан СН4:

У молекулі метану атом Карбону утворює чотири ковалентні зв’язки за рахунок 1 s- і 3-р орбіталей, а кожний атом Гідрогену за рахунок s-орбіталі. При sp3-гібридизації атома Карбону кут, що утворюють між собою чотири його електронні хмари рівний 10928' (найбільш вигідне розташування). Просторове розміщення атомів у молекулах алканів відображає тетраедрична модель.
|
Рис.1. Модель sp3-гібридного стану електронної оболонки атома Карбону. |
Насичені вуглеводні утворюють ряд сполук, в якому наступний член відрізняється за складом від попереднього на постійну величину, що дорівнює СН2.Такий ряд називається гомологічним, а окремі члени його – гомологами (табл.1).
Таблиця 1.
Фізичні константи деяких насичених вуглеводнів.
Назва |
Формула |
Тпл, оС |
Ткип, оС |
Метан |
|
-182,5 |
-101,5 |
Етан |
|
-173,3 |
-88,6 |
Пропан |
|
-187,7 |
-42,7 |
Бутан |
|
-138,3 |
-0,5 |
Пентан |
|
-129,7 |
+36,7 |
Гексан |
|
-95,3 |
68,7 |
Гептан |
|
-90,6 |
98,4 |
Октан |
|
-56,8 |
125,7 |
Нонан |
|
-53,5 |
150,8 |
Декан |
|
-29,6 |
174,1 |
Пентадекан |
|
+10 |
270,5 |
Ейкозан |
|
36,8 |
342,7 |
Пентакозан |
|
53,7 |
400 |
Триаконтан |
|
65,8 |
446,4 |
Гектан |
|
115,2 |
- |
Постійна різниця в складі між суміжними членами гомологічного ряду СН2 називається гомологічною різницею.
Явище існування гомологів і гомологічних рядів дістало в органічній хімії назву гомології. Гомологія властива й іншим класам органічних речовин, причому для всіх гомологічних рядів гомологічною різницею є група -СН2.