
- •Fe(железо).
- •Простое вещество.
- •1. Химические свойства.
- •С растворами солей.
- •1. Химические свойства.
- •Fe(oh)2 – гидроксид железа (II).
- •1. Химические свойства.
- •Основные свойства
- •Восстановительные свойства
- •Восстановительные свойства.
- •Гидролиз солей.
- •Электролиз растворов солей:
- •1. Химические свойства.
- •Соли Fe(III). Химические свойства.
- •II. Гидролиз.
- •IV. Термическое разложение солей.
- •V. Качественные реакции:
- •Fe3o4 -- оксид железа(II) и железа(III) – (Окалина, магнетит)
- •Химические свойства.
- •С кислотами – окислителями - hno3 (овр):
- •II.Оксиды и гидроксиды
- •Соли железа (III)
Fe(железо).
Железо находится в побочной подгруппе VIII группы IV периода. Как все элементы побочных подгрупп, железо имеет валентные электроны как на внешнем, четвертом, так и на третьем, предпоследнем уровне – это d-элемент, металл:
F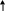 e
1S2 2S2 2P6 3d6 4S2
e
1S2 2S2 2P6 3d6 4S2
|
|
|
|
|
|
4 |
|
d S
В соединениях для него характерны валентности II и III, а степени окисления +2 и +3. (Известны соединения Fe(VI), однако на практике с ними приходится встречаться редко.)
Кроме Fe, в этой побочной подгруппе находятся Co и Ni, которые обнаруживают большое сходство с Fe, а потому объединяются с ним в триаду железа, или семейство железа.
Для соединений железа, как и для большинства d-элементов характерны:
1) окислительно-восстановительные реакции.
Fe2+ -1ē ¬®Fe3+
2) реакции комплексообразования.
Простое вещество.
1. Химические свойства.
Железо металл со средней химической активностью. Чистое железо в отсутствии влаги на воздухе не меняется, химическая активность его возрастает с увеличением в нем содержания примесей.
I. Взаимодействие Fe с простыми веществами:
с галогенами, при нагревании.
2Fe + 3Cl2 t → 2FeCl3
с кислородом.
при недостатке кислорода.
2Fe + O2 → 2FeO
при накаливании на воздухе или в кислороде железо сгорает, образуя железную окалину.
3Fe + 2O2 t → Fe3O4 (Fe2O3 FeO)
в избытке O2.
4Fe + 3O2 t → 2Fe2O3
c серой.
Fe + S t → FeS Железо окисляется до степени окисления +2.
ЗАПОМНИТЕ: сильные окислители окисляют железо до Fe(III), а более слабые до Fe(II).
c углеродом.
При нагревании образуется карбид железа Fe3C ( цементит), состав которого не соответствует обычным валентностям этих элементов, а определяется структурой соединения.
3Fe + C t → Fe3C
c азотом при нагревании образуется нитрид.
2Fe + N2 t → 2FeN
Во влажном воздухе железо постепенно подвергается коррозии – ржавлению.
4Fe + O2 + 6H2O → 4Fe(OH)3
II. Взаимодействие Fe cо сложными веществами.
с парами воды и оксидами при высокой температуре.
t
3Fe + 4H2O ⇄ Fe3O4 + 4H2
t
Fe + CO2 ⇄ FeO + CO
с растворами кислот.
Fe реагирует с кислотами, не проявляющими окислительных свойств аниона, с выделением водорода, окисляясь до Fe(II).
Fe + 2HCl → FeCl2 + H2↑
Fe + H2SO4 → FeSO4 + H2↑
разб.
с кислотами окислителями HNO3, HNO3,H2SO4.
разб, конц. конц.
1. Fe +4 HNO3 → Fe(NO3)3 + NO ↑+ 2H2O
разб.
Под действием концентрированных серной и азотной кислот при комнатной температуре железо пассивируется: на его поверхности образуется прочная оксидная пленка, препятствующая дальнейшему воздействию.
Однако при нагревании железо реагирует с H2SO4 конц., окисляясь до степени окисления +3.
t
2. Fe + 6H2SO4 → Fe2(SO4)3 + 3 SO2↑ + 6H2O
конц.

 3
3