
- •3.Основное уравнение массопередачи
- •4.Материальный баланс массообменного процесса
- •5.Рабочая линия
- •6.Графическое представление массообменного процесса
- •7.Движущая сила массообменных процессов
- •8.Средняя интегральная разность концентраций
- •Способы выражения составов фаз
- •Правило фаз Гиббса
- •Насыщенные и ненасыщенные пары
- •Равновесие идеальных бинарных смесей, изотерма паровой и жидкой фазы
- •Графический расчет равновесных составов паров и жидкости
- •К ривая равновесия фаз
- •Изобарно-температурные кривые
- •Энтальпийная диаграмма
- •Равновесие бинарных смесей, частично отклоняющихся от закона Рауля; коэффициент активности
- •Азеотропные смеси
- •Равновесие частично смешивающих жидкостей; гетероазеотропы
- •1) Это смеси, растворяющиеся друг в друге при определенной температуре в каком-то пределе, а за пределами температуры имеют 2 жидкие фазы.
- •Способы перегонки жидкостей
- •Однократное испарение
- •Постепенное испарение
- •Постепенная конденсация
- •Многократное испарение
- •Многократная конденсация
- •Сущность процесса ректификации
- •Принципиальное устройство ректификационной колонны
- •Материальный баланс ректификационной колонны
- •Расчет минимальных флегмовых и паровых чисел
- •Уравнение рабочей линии верхней части колонны
- •Уравнение рабочей линии для нижней части колонны
- •Тепловой баланс для верхней части колонны
- •Тепловой баланс для нижней части колонны
- •Способы создания орошения в колонне; парциальный конденсатор
- •Холодное испаряющееся орошение
- •Циркуляционное орошение
- •Способы подвода тепла в низ колонны
- •Выбор давления при ректификации
- •Особенности работы колонны с вводом водяного пара
- •Сущность процесса экстракции
- •Виды экстракции
- •Треугольная диаграмма и ее свойства
- •Свойства треугольной диаграммы
Изобарно-температурные кривые
Полученные при разных t равновесные составы жидкой и паровой фаз при давлении π можно представить в системе координат t - , .
Изобарно-температурные кривые позволяют установить связь между Т кипения системы и составом жидкой и паровой фаз.
T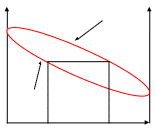
B 2 точка А - = =1 – температура кипения НКК ( ).
перегретый точка B - = =0 – температура кипения ВКК ( ) .
пар 1 - линия кипения.
пар + 2 – линия конденсации.
S S’ SS’- конода, линия соединяющая точки равновесных
жидкость составов жидкой и паровой фаз.
1 A
жидкая фаза
,
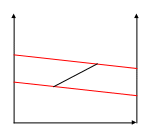
Энтальпийная диаграмма
![]()
Энтальпийная диаграмма связывает составы жидкой и паро
вой фаз с их энтальпиями. Их используют при расчетах рек
перегретый пар тификации, когда нужно знать тепловые потоки.
![]()
![]() -
для жидкой фазы
-
для жидкой фазы
S’
![]()
![]() -
для паровой фазы, где
-
для паровой фазы, где
h, H- энтальпии компонентов в жид и пар.ф
![]() S
SS’- конода
S
SS’- конода
![]() -
-
энтальпия паровой фазы
-
-
энтальпия паровой фазы
жидкость - - энтальпия жидкой фазы
x,y
энтальпия НКК в жидкой фазе. - энтальпия ВКК в паровой фазе.
- энтальпия ВКК в жидкой фазе. - энтальпия НКК в паровой фазе.
Равновесие бинарных смесей, частично отклоняющихся от закона Рауля; коэффициент активности
Закон Рауля: ”парциальное давление компонента идеального раствора равно произведению давления насыщенных паров при данной температуре на мольную долю компонента в жидкой фазе”
для НКК -
для ВКК -
Положительное отклонение будет тогда, когда парциальные давления и общее давление системы будет больше величин, вычисленных по закону Рауля. На диаграммах кривая равновесия фаз и изобарно-температурные кривые выглядят так же как для идеального раствора (температуры кипящей жидкости и нас.паров повышаются с уменьшением концентрации НКК в жидкости и паре). КРФ характеризуется тем, что концентрация НКК в паровой фазе выше, чем в жидкости при любом составе жидкой фазы.
![]() - изотерма жидкой фазы,
- изотерма паровой фазы,
- изотерма жидкой фазы,
- изотерма паровой фазы,
![]() -
парциальное давление ж.ф,
-
парциальное давление ж.ф,
![]() -
парц.давление п.ф.
-
парц.давление п.ф.
Отрицательное отклонение будет тогда, когда парциальные давления и общее давление системы будет меньше величин, вычисленных по закону Рауля.
Коэффициент активности характеризует
степень данного раствора от идеального.
![]() жидкости).
жидкости).
Закон Рауля с учетом γ: для НКК
![]() и для ВКК
и для ВКК
![]() .
.
Состав равновесной жидкости:
![]() .
.
Состав равновесного пара:
![]()
При положит.откл γ>1, а при отрицат.откл γ<1.

