
- •3.Основное уравнение массопередачи
- •4.Материальный баланс массообменного процесса
- •5.Рабочая линия
- •6.Графическое представление массообменного процесса
- •7.Движущая сила массообменных процессов
- •8.Средняя интегральная разность концентраций
- •Способы выражения составов фаз
- •Правило фаз Гиббса
- •Насыщенные и ненасыщенные пары
- •Равновесие идеальных бинарных смесей, изотерма паровой и жидкой фазы
- •Графический расчет равновесных составов паров и жидкости
- •К ривая равновесия фаз
- •Изобарно-температурные кривые
- •Энтальпийная диаграмма
- •Равновесие бинарных смесей, частично отклоняющихся от закона Рауля; коэффициент активности
- •Азеотропные смеси
- •Равновесие частично смешивающих жидкостей; гетероазеотропы
- •1) Это смеси, растворяющиеся друг в друге при определенной температуре в каком-то пределе, а за пределами температуры имеют 2 жидкие фазы.
- •Способы перегонки жидкостей
- •Однократное испарение
- •Постепенное испарение
- •Постепенная конденсация
- •Многократное испарение
- •Многократная конденсация
- •Сущность процесса ректификации
- •Принципиальное устройство ректификационной колонны
- •Материальный баланс ректификационной колонны
- •Расчет минимальных флегмовых и паровых чисел
- •Уравнение рабочей линии верхней части колонны
- •Уравнение рабочей линии для нижней части колонны
- •Тепловой баланс для верхней части колонны
- •Тепловой баланс для нижней части колонны
- •Способы создания орошения в колонне; парциальный конденсатор
- •Холодное испаряющееся орошение
- •Циркуляционное орошение
- •Способы подвода тепла в низ колонны
- •Выбор давления при ректификации
- •Особенности работы колонны с вводом водяного пара
- •Сущность процесса экстракции
- •Виды экстракции
- •Треугольная диаграмма и ее свойства
- •Свойства треугольной диаграммы
Способы выражения составов фаз
 (1) - массовые доли компонентов в
жидкой (
(1) - массовые доли компонентов в
жидкой (![]() )
и паровой фазе (
)
и паровой фазе (![]() );
где g и G-
);
где g и G-
 (1) массы жидкой и паровой фаз,
(1) массы жидкой и паровой фаз,
![]() и
и
![]() -компонент
жид/пар.фазы.
-компонент
жид/пар.фазы.
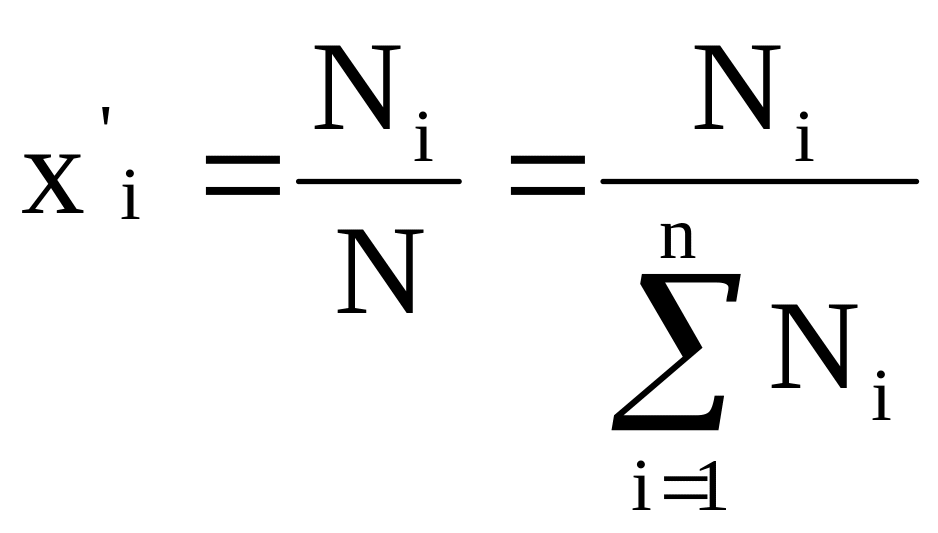 (2) - мольные доли компонентов в
жидкой (
(2) - мольные доли компонентов в
жидкой (![]() )
и паровой фазе (
)
и паровой фазе (![]() );
где
);
где
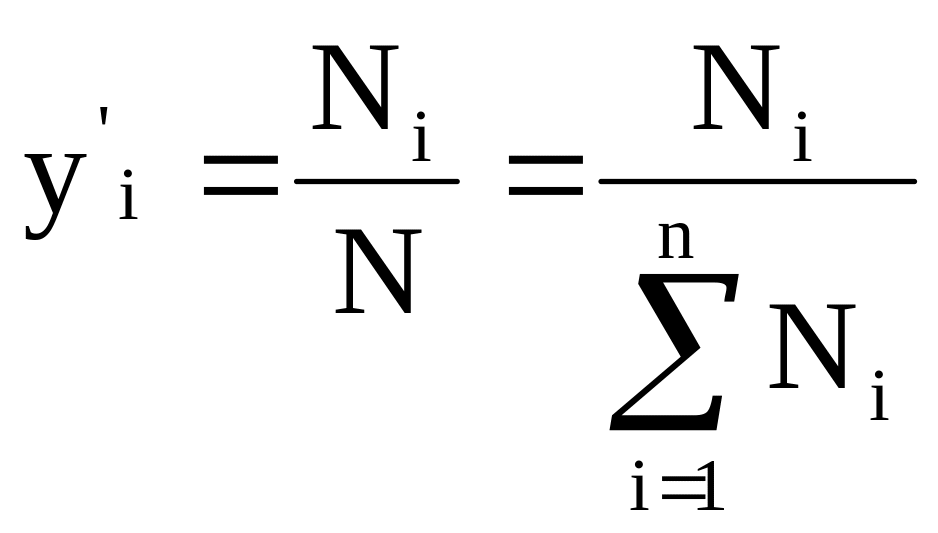 (2)
(2)
![]() -число
молей компонента и N-общее
число молей смеси.
-число
молей компонента и N-общее
число молей смеси.
![]() ,
,
,
,
,
,
![]()
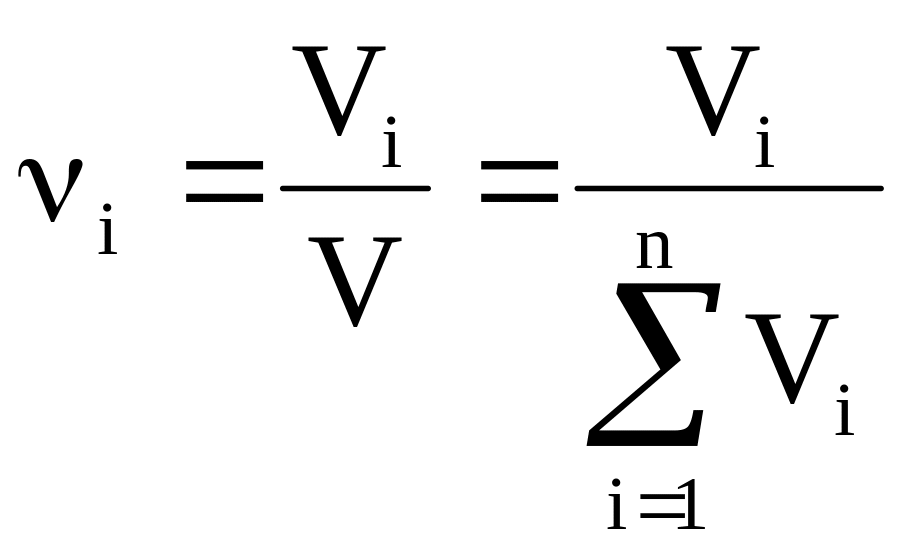 (3) - объемная доля компонента; где
(3) - объемная доля компонента; где
![]() -объем
компонента и V-общий объем.
-объем
компонента и V-общий объем.
![]() ,
,
![]()
Пересчет массовых и мольных долей:
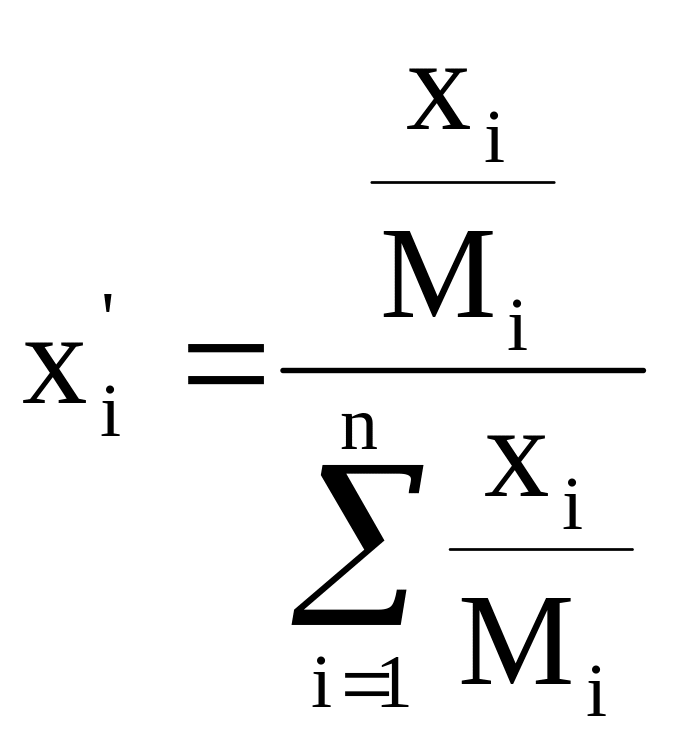 и
и
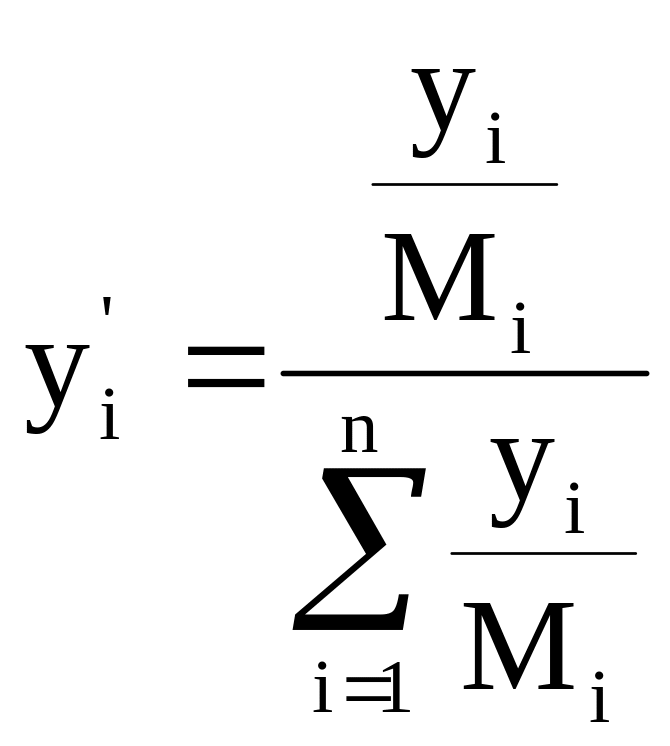 - переход из мольных в массовые доли.
- переход из мольных в массовые доли.
 и
и
 - переход из массовых в мольные доли.
- переход из массовых в мольные доли.
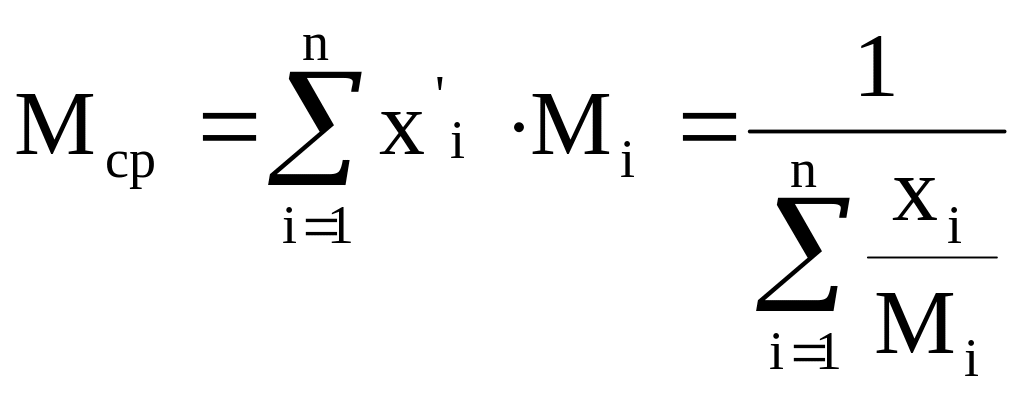 и
и
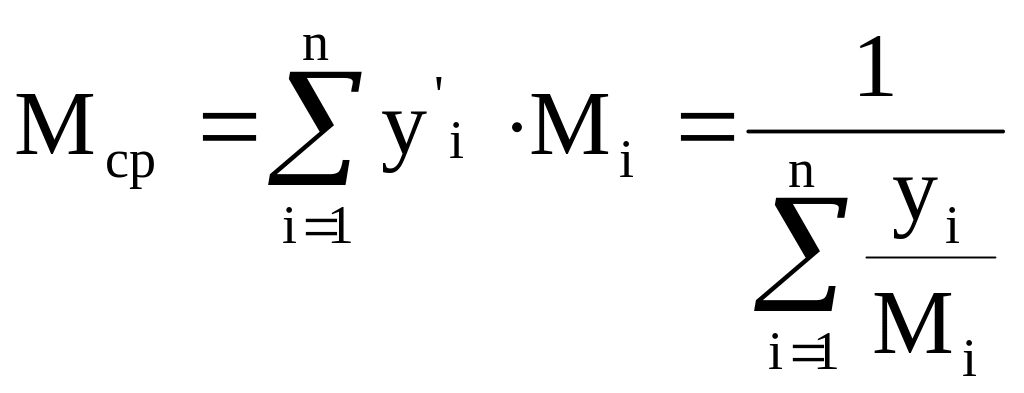 - средняя мольная/массовая масса
смеси.
- средняя мольная/массовая масса
смеси.
![]() -
пересчет массовой доли в объемную.
-
пересчет массовой доли в объемную.
![]() - средняя плотность смеси.
- средняя плотность смеси.
![]() - объемная концентрация.
- объемная концентрация.
Правило фаз Гиббса
Состояние равновесия характеризуется правилом фаз Гиббса, которое определяет связь между числом степеней свободы, числом ее компонентов и числом фаз.
Число независимых параметров, которые могут быть выбраны произвольно, чтобы привести систему в состояние равновесия – число степеней свободы.
![]() где L – число степеней
свободы n – число
компонентов N – число
фаз
где L – число степеней
свободы n – число
компонентов N – число
фаз
В качестве степеней свободы могут выступать t,P,c
Для 2-х компонентной системы взаимно растворимых жидкостей L=2, а для нерастворимых L=1
Вывод уравнения:
1) Пусть система содержит N фаз и n компонентов в каждой фазе.
2) Состояние фаз фиксировано при Р и Т.
3) Состав каждой фазы можно рассчитать,
задавая n-1 концентраций
компонентов, а концентрация одного из
компонентов является зависимой величиной
и может быть рассчитана из условия, что
сумма мольных долей всех компонентов
в смеси равна 1.
![]()
4)
![]() - общее число переменных, определяющих
состояние системы.
- общее число переменных, определяющих
состояние системы.
5)
![]() -
общее число уравнений для расчета
состояния системы, где (N-1)
– число уравнений,
-
общее число уравнений для расчета
состояния системы, где (N-1)
– число уравнений,
достаточных для расчета концентрации компонентов, n – число переменных.
6) Число уравнений не может превышать числа переменных, иначе уравнения будут несовместимыми. Разность между числом независимых переменных и числом уравнений равна числу произвольно изменяемых параметров в данной системе, меняя которые можно не менять число фаз в ней (степень свободы):
![]()
Насыщенные и ненасыщенные пары
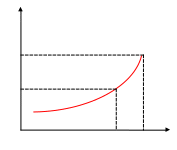
Насыщенный пар – пар, находящийся в равновесии с жидкостью. Ненасыщенный (перегретый) пар – пар, который при данных Т и Р образует паровую систему без жидкой фазы. Ненасыщенные пары могут существовать при данном давлении, если их температура будет больше температуры насыщенных паров или при данной температуре, если их давление меньше давления насыщенных паров.
 Р
Р
АК- зависимость насыщенных паров от Т.
Каждая точка на кривой АК связывает давление
насыщенных паров с температурой кипения ж-ти.
К Состояние, при котором исчезает различие между
![]() жидкой и газовой фазами – критическое
состояние.
жидкой и газовой фазами – критическое
состояние.
жидкая фаза
![]() -
максимальная Т, при которой жидкая и
пар.ф
-
максимальная Т, при которой жидкая и
пар.ф
Р существуют в равновесии.
С - Р, при котором вещество может быть в жид.с
А ненас при .
пар
Т
![]() Т
Т
Классификация бинарных смесей
Бинарные смеси делятся на три группы в зависимости от степени их взаимной растворимости:
- нерастворимые
- частично растворимые
- взаимно растворимые: - образующие идеальные растворы
- частично отклоняющиеся от закона Рауля
- неидеальные растворы, значительно отклоняющиеся от закона Рауля
Основные законы фазового равновесия
Рассмотрим 3 основных закона фазового равновесия: закон Рауля, закон Дальтона и закон Генри.
1) Закон Рауля:
“Парциальное давление
![]() компонента идеального жидкого раствора
равно произведению давления насыщенных
паров
компонента идеального жидкого раствора
равно произведению давления насыщенных
паров
![]() компонента при данной температуре на
мольную долю компонента
компонента при данной температуре на
мольную долю компонента
![]() в жидкой фазе”.
в жидкой фазе”.
![]()
2) Закон Дальтона:
“Парциальное давление компонента
газовой смеси
равно произведению давления в системе
π на мольную долю компонента
![]() в газовой смеси”.
в газовой смеси”.
![]()
Закон Дальтона является следствием уравнения Менделеева-Клапейрона:
![]() (1)
(1)
![]() (2)
(2)
 (3)
(3)
из урав (2) и (3) →
![]()
3) Закон Генри:
“Парциальное давление компонента прямо пропорцииально его мольной концентрации”. Закон справедлив для разбавленных растворов.
![]()
![]() - константа фазового равновесия данного
компонента смеси.
- константа фазового равновесия данного
компонента смеси.
![]() - для идеальных растворов.
- для идеальных растворов.
![]() компонента).
компонента).
