
- •Методика розв’язування розрахункових задач
- •1. Введення. Актуальність і мета обраної теми 3
- •2. Типи розрахункових задач. 4
- •3. Висновки 19
- •4. Список використаних джерел 20
- •Введення. Актуальність і мета обраної теми
- •2. Типи розрахункових задач.
- •2.1. Обчислення масової частки елемента в складі речовини за її хімічною формулою
- •2.2. Обчислення числа атомів (молекул) у певній кількості речовини
- •2.3. Обчислення маси речовини за відомою кількістю і кількості речовини за відомою масою
- •2.4. Обчислення маси, об’єму та кількості речовини за рівнянням реакції
- •2.5. Обчислення, пов’язані з молярним об’ємом
- •2.6. Обчислення, пов’язані з відносною густиною газів
- •2.7. Обчислення на застосування закону об’ємних відношень газів
- •2.8. Обчислення за термохімічними рівняннями реакцій
- •2.9. Обчислення з використанням понять, пов’язаних з розчинами
- •2.10. Розв’язування задач на домішки
- •2.11. Обчислення, пов’язані з масовою та об’ємною частками виходу продукту реакцій
- •2.12. Обчислення за хімічним рівнянням, якщо одна з реагуючих речовин дана в надлишку
- •2.13. Знаходження молекулярної формули газоподібної речовини за масовими частками елементів і відносною густиною за іншим газом
- •2.14. Встановлення молекулярної формули речовини за продуктами згоряння
- •3. Висновки
- •4. Список використаних джерел
2.3. Обчислення маси речовини за відомою кількістю і кількості речовини за відомою масою
Обчислення здійснюють, виходячи з формули:
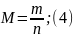
де M — молярна маса речовини (г/моль); m — маса речовини (г, кг, т); n — кількість речовини (моль).
Задача. Обчисліть масу ферум (III) оксиду, узятого в кількості речовини 5 моль.
Д ано:
Розв’язання
ано:
Розв’язання
Із формули (4) маємо: m = M • n.
Знаходимо масу 5 моль ферум 23 (ІІІ) оксиду:
m(Fe2О3) = M(Fe2О3) • n(Fe2О3) = 160 г/моль • 5 моль = 800 г.
Відповідь: маса 5 моль ферум (III) оксиду дорівнює 800 г.
Задачі для самостійного розв’язування
1. Визначте молярну масу речовин: а) кальцій оксиду СаО; б) натрій оксиду Na2O; в) алюміній хлориду АlС13.
2. Визначте молярну масу речовини, якщо відомо, що: а) 7 моль її мають масу 448 г; б) 3,5 моль її мають масу 84 г; в) 0,25 моль її мають масу 8 г.
3. Визначте масу натрій карбонату кількістю речовини 0,25 моль.
2.4. Обчислення маси, об’єму та кількості речовини за рівнянням реакції
Алгоритм розв’язування:
1. Короткий запис умови задачі.
2. Запис рівняння реакції, розстановка коефіцієнтів, перевірка правильності запису.
3. Запис над формулами речовин даних з умови задачі.
4. Запис під формулами речовин даних з рівняння реакції.
5. Перевірка розмірності одиниць над формулами та під формулами речовин, яка має бути однаковою.
6. Складання пропорції і здійснення обчислень.
Задача. Яка маса фосфору та який об’єм кисню витратяться на утворення 4 моль фосфор (V) оксиду?
 Дано:
Розв’язання
Дано:
Розв’язання
Хг Yл 4моль
4Р + 5О2 = 2Р2О5
n=4моль n=5моль n=2моль
m=4•31г V=5•22,4л
Визначаємо масу фосфору, яка витратиться на утворення 4
моль Р2О5.
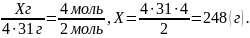
2. Обчислюємо об’єм кисню.
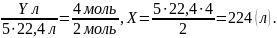
Відповідь: m(Р) = 248 г, V(O 2 ) = 224 л.
Задачі для самостійного розв’язування
1. Який об’єм H2 виділиться внаслідок взаємодії магнію масою 4,8 г з HCl?
2. Яка маса алюміній оксиду утвориться в результаті окиснення 0,2 моль алюмінію?
3. Яка кількість речовини метану (СН4) утвориться під час взаємодії 224 л водню з вуглецем?
2.5. Обчислення, пов’язані з молярним об’ємом
Молярний об’єм Vm дорівнює відношенню об’єму газу до його кількості:
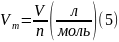
За нормальних умов Vm = 22,4 л/моль для будь якого газу.

Задача. Обчисліть об’єм кисню (за н.у.), узятого в кількості 0,2 моль.
Д ано:
Розв’язання
ано:
Розв’язання
Із формули (5) маємо:
V = Vm • n.
Знаходимо об’єм 0,2 моль 2 кисню:
V(О2) = Vm • n(О2) ; V(О2) = 22,4 • 0,2 = 4,48 л.
Відповідь: V (О2) = 4,48 л.
Задачі для самостійного розв’язування
1. Який об’єм займе водень кількістю речовини 10 моль?
2. Обчисліть об’єм вуглекислого газу СО2, узятого в кількості 5,5 моль.
3. Яку кількість речовини становлять 448 л метану СН4?
2.6. Обчислення, пов’язані з відносною густиною газів
Відносна густина газу D — це величина, яка дорівнює відношенню маси певного об’єму одного газу до маси такого самого об’єму іншого газу за однакових умов.
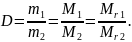
Відношення мас рівних об’ємів газів за однакових умов дорівнює відношенню їх молярних (відносних молекулярних) мас.
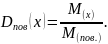
M r (повітря) = 29.
Задача 1. Обчисліть відносну густину сульфур (IV) оксиду за воднем і повітрям.
Д ано:
Розв’язання
ано:
Розв’язання
1. Знаходимо відносну густину сульфур (IV) оксиду за воднем.
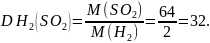
Яка відносна густина сульфур (IV) оксиду за повітрям?
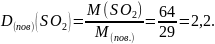
Відповідь: DН2(SО2) = 32, D(пов.)(SО2) = 2,2.
Задача 2. Маса газоподібної сполуки об’ємом 1 л (н. у.) дорівнює 1,52 г. Знайдіть молярну масу газу і його густину за воднем.
 Дано:
Розв’язання
Дано:
Розв’язання
1. Знаючи масу газу об’ємом 1 л (н. у.), обчислюємо його молярну масу за формулою (6):
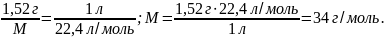
2.
Визначаємо густину газу за воднем за
формулою
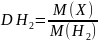
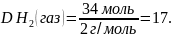
Відповідь: молярна маса газу дорівнює 34 г/моль; густина за воднем дорівнює 17.
Задачі для самостійного розв’язування
1. Густина газу за воднем дорівнює 17. Визначте молярну масу газу.
2. Обчисліть густину за гелієм: а) азоту; б) кисню; в) амоніаку; г) метану.
3. Визначте відносну густину за воднем і за повітрям карбон(ІУ) оксиду.
