
- •Проблемы в области очистки природных вод и возможные пути их решения.
- •Формы нахождения железа в природных водах. Нормирование содержания железа в питьевой воде. Классификация методов обезжелезивания.
- •Обезжелезивание воды. Безреагентный метод. Сущность процессов, технологические схемы.
- •Реагентное обезжелезивание. Химическая сущность процесса, технологи-ческие схемы.
- •Деманганация природных вод. Требования СаНПиН. Безреагентные методы - сущность процессов, технологические схемы.
- •7.Деманганация. Реагентные методы. Сущность процесса, технологические схемы.
- •8.Фторирование воды. Требования СаНПиН. Характеристика реагентов для фторирования питьевой воды и способы их дозирования.
- •9.Методы фторирования воды. Технологические схемы, принцип расчета
- •10.Дефторирование воды. Сущность процессов. Технологические схемы
- •11.Удаление сероводорода из природных вод. Химический и физический методы. Сущность процессов. Технологические схемы
- •13. Удаление метана из природных вод. Сущность процессов, технологии.
- •14. Сорбционная очистка природных вод. Биосорберы - принцип работы, технологическая схема. Конструкции адсорберов и основы их расчета.
- •15.Виды, состав и свойства осадков водопроводных станций. Классификация методов обработки осадков.
- •16. Механическое обезвоживание осадков
- •17. Обработка осадков станций водоподготовки с одновременной регенерацией коагулянта
- •18.Обеззараживание воды гипохлоритом натрия. Установки «Хлорэфс» - принцип работы, возможные технологические схемы.
Деманганация природных вод. Требования СаНПиН. Безреагентные методы - сущность процессов, технологические схемы.
Согласно СанПиН: CMn2+≤0,1мг/л в питьевой воде.
Безреагентные способы удаления:
Вакуумно-эжекционная аэрация с фильтрованием.
Mn2++Fe2+
Fe2+->Fe3+=>Fe(OH)3 на котором сорбируется и окисляется Mn2+
Mn2+ искусственно вводят в раствор FeSO4
удаление в пласте (см. обезжелезивание)
Биохимический метод. Используются аэробные микроорганизмы рН=4-10, t=0-40

7.Деманганация. Реагентные методы. Сущность процесса, технологические схемы.
Данный способ универсален, используется при любом качестве воды и любой производительности. Принцип: Mn2+ MnO2 (сорбент) Г=300 мг/л,а значит хорошо удаляет запахи и привкусы.
Mn2+ + MnO4− + H2O = MnO2 (в осадок) + H+
а)поверхностные воды.
97% марганца удаляется при D KMnO4 = 2 мг/л Mn2+
KMnO4 можно вводить на НС1 или за 5-10 минут до смесителя.

б)подземные воды.

Р астворимость
KMnO4
астворимость
KMnO4
J подачи воды = 4-5
t(теплая вода) =2-3 часа
t(холодная вода)=4-5 часов
q KMnO4 = (Qчас *DKMnO4)/CKMnO4 ,м3/ч
Концентрация каждой порции KMnO4 определяется после приготовления титриметрическим способом.
Сильные окислители используются для перевода Mn2+ MnO2 :
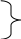 DCl2=1,3
мг Cl2/мг
Mn2+
DCl2=1,3
мг Cl2/мг
Mn2+
DO2=1,45 мг O2/мг Mn2+ +коагулянт(флокулянт)+ГО+СФ DClO2=1,35 мг ClO2/мг Mn2+
При необходимости подщелачивают. рН=8-9
Деманганация на модифицированной загрузке.
Загрузка СФ последовательно обрабатывается раствором подаваемым снизу вверх-
0,5% MnCl2, 0,5% KMnO4 – время контакта 20-30 минут.
затем происходит фильтрация ,скорость 8-10 м/час с течением времени на загрузке образуется Mn(OH)4-катализатор и сорбент.
Можно использовать так же природный минерал пиролюзит MnO2*H2O
«-» способа :
большой расход реагента;
постепенное измельчение и проскок в фильтрат частиц .
8.Фторирование воды. Требования СаНПиН. Характеристика реагентов для фторирования питьевой воды и способы их дозирования.
Фтор – газ. М=19,чаще встречается в виде соединений( CaF2 – плав. шпат)
Недостаток фтора в организме ведет к кариесу (CF < 0,3-0,5 мг/л) ,переизбыток же фтора CF >3-5 мг/л ведет к таким заболеваниям как флюороз, хрупкость костей, сердечно-сосудистые заболевания, рахит, малокровие, ухудшение состояния.
Согласно СанПиН необходимое количество фтора в воде зависит от климата, показаний санитарной токсикологичности.
1 и 2 климатические районы(Север) :
С F max =1,5 мг/л
3 район ( Юг) : С F max =1,2 мг/л С F min =0,7 мг/л
В водах планеты чаще недостаток фтора, реже избыток (Африка до 100 мг/л) .
Есть два варианта фторирования : 1) Доза фтора постоянная в течение года;
2) Доза фтора меняется в течение сезонов года.
Требования к реагентам .
Фтор. реагенты: NaSiF6 – 60%
H2SiF6 – 23% NaF – 13 %
NaSiF6 – доступен ,выгоден . Концентрация вещества в техническом продукте ~93-98 % .
Не гигроскопичен. Растворимость плохая, она уменьшается при понижении t-ры.
рН 1-2% раствора равен 3-4.
Белый кристаллический порошок. Поступает в барабан объемом 50 л.
NaF - растворимость не меняется от t~ 4% растворяется. рН = 7,5-8,5 . Приготавливают на жесткой воде, дает много осадка .
H2SiF6 - побочный продукт получения F соединений . Бесцветная, дымящаяся жидкость , с едким запахом. Концентрация 8-14%, дешево.
Применяют на ВОС рядом с изготовителем.
(NH4)2SiF6 – Концентрация основного вещества >93%
Сильно слеживается, а значит необходимо сушить/дробить.
Фторируют воду растворами перечисленных веществ ,добавляя их:
до фильтр.сооруж. (при малой нагрузке на них) ;
после СФ(КО) . (перед РЧВ или в РЧВ)
D F = (104 * mф * Сф, конц * С ф,исх) /Сф*Кф , мг/л
mф – коэффициент зависящий от места введения фтора. Ввод до СФ = 1,1; ввод после СФ=1.
Сф,конц/исх – конц. после обработки;
Сф – концентрация в техническом продукте чистого реагента(%) ;
Кф- количество ионов фтора в чистом реагенте(%).
