
Министерство образования и науки Российской Федерации Северо-Западный государственный медицинский университет им. И.И. Мечникова
Кафедра патологической физиологии
Взаимодействие печени и иммунной системы
Руководитель: Булгакова О.С.
выполнили: студенты 3 курса
лечебного факультета
358 группы
кутузов М.О.
раджабов Р.М.
Санкт-Петербург
2016
Содержание
Введение 3
Значение для организма 4
Нарушение взаимодействия 7
Применение в медицинской практике 9
Список литературы 9
Введение 3
Значение для организма 4
Нарушение взаимодействия 7
Применение в медицинской практике 9
Список литературы 10
Введение
Огромную роль в метаболических процессах организма, а также в неспецифических и специфических реакциях иммунной системы играет печень как составная часть пищеварительной системы, имеющая очень широкий функционально - метаболический спектр:
печень состоит не только из гепатоцитов, но и из клеток, которые формируют строму и относятся к иммунной системе - это фиксированные макрофаги (клетки Купфера), эндотелиальные клетки, pit-клетки;
в печени находится большое количество полиморфно ядерных лейкоцитов, Т- и В-лимфоцитов;
в печени синтезируются некоторые вещества системы гомеостаза, неспецифической резистентности, которые тесно взаимодействуют с иммунной системой в норме и при патологии.
Основное место образования и развития лимфоцитов - эмбриональная печень. Функцию печеночных клеток регулируют цитокины, которые играют важную роль в регуляции иммунологических процессов: ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-9. В норме в печени находятся различные лимфоциты, в синусоидах печени находятся pit-клетки, которые встречаются и в других органах. Pit-клетки имеют хорошо развитые псевдоподии и цитоплазматические гранулы, принадлежат к зернистым лейкоцитам, обладают литической активностью и осуществляют иммунологический надзор в печени.
Значение для организма
Печень играет основную роль в регуляции уровня антигенов, которые поступают из просвета кишечника или других органов в системный кровоток, а из него в лимфоидные органы. Доказано, что количество клеток Купфера пополняется за счет их локальной пролиферации и притока клеток - предшественников промоноцитов и моноцитов крови. Таким образом, клетки печени ассоциированы с широким спектром биологически активных молекул, которые играют важную роль в процессах воспаления и иммунитета, особенно при аллергической патологии.
Гепатобилиарная система тесно связана с регионарными механизмами иммунной защиты пищеварительного тракта. Это, в первую очередь, относится к 1дА и 1дО. Очищают кровь от патогенных бактерий и бактериальных эндотоксинов клетки Купфера. После поглощения эндотоксина, клетки Купфера выделяют цитокины (ИЛ-1, ИФН, ФИО).
Несмотря
на то, что большинство аутореактивных
Т-клеток уничтожается в тимусе, механизмы,
чтобы инактивировать или контролировать
Т-клетки, специфичные для сверхтимусовых
антигенов необходимы и существуют на
периферии. Исследуя участок, в котором
авто реактивные Т-клетки толерантны,
был идентифицирован уникальный механизм
периферического удаления, в котором
аутореактивные CD8
Т-клетки
быстро поглощаются печенью после внутри
- печеночной  активации.
После проникновения Т-клеток в гепатоциты
происходит активация эндосомально -
лизосомальных
структур и последующая их дегенерация.
активации.
После проникновения Т-клеток в гепатоциты
происходит активация эндосомально -
лизосомальных
структур и последующая их дегенерация.
Активное внедрение одной клетки в другую без повреждения последней или эмпериполез, является давно наблюдаемым явлением, физиологическая роль которого не была выяснена. Данный феномен представляет собой уникальный механизм разрушения аутореактивных Т-клеток, препятствующий приобретению цитотоксической функции этих клеток и необходимый для поддержания толерантности.
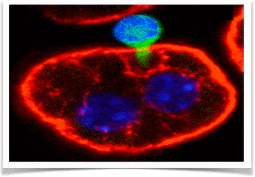
Периферическое “удаление” является основным механизмом разрушения аутореактивных Т- клеток. Молекулярные механизмы, приводящие к периферическому ”удалению” и/или истощению аутореактивных CD8 Т-клеток были разделены, а роль незрелых дендритных клеток в лимфоидной ткани была описана. Тем не менее, не ясно, могут ли другие участки способствовать периферическому ”удалению”,играющему определенную роль в уничтожении аутореактивных Т-клеток.
Рециркуляция CD8 Т- клеток ограничена кровью и лимфой, а первичная и основная активации Т-клеток ограничены лимфоидными органами (лимфатические узлы, селезенка, костный мозг, печень). Таким образом, вероятно, что толеризация аутореактивных Т-клеток на периферии детерминирована этими структурами.
За последние десять лет в печени были обнаружены белки, которые обладают выраженной иммуносупрессивной активностью. Эндотелиальные клетки печени способны продуцировать медиаторы воспаления и иммунитета (ИЛ-1, ИЛ-6), Гепатоциты под действием внешних стимулов синтезируют и секретируют некоторые компоненты системы комплемента (03, В-фактор), а также интерлейкины (ИЛ- 6, ИЛ-8). Под действием цитокинов гепатоциты продуцируют белки острой фазы воспаления, которые являются факторами механизмов гомеостаза, направлены на защиту организма от патогенных агентов и различных чужеродных компонентов. К белкам острой фазы воспаления принадлежит, прежде всего, С-реактивный белок (СРБ), При поражении тканей его продукция резко повышается под действием ИЛ-1.
Многочисленные исследования показали; что СРБ характеризуется полифункциональностью, играет важную роль в возникновении воспалительных и иммунологических реакций, стимулирует и регулирует классический и альтернативный пути активации комплемента, регулирует функцию тромбоцитов, стимулирует продукцию цитокинов, опсонизирует мертвые клетки, усиливает клеточную цитотоксичность, объединяясь с хроматином, который высвобождается из поврежденных клеток, удаляя его из поврежденных участков.
Цитохром
Р-450 зависимые монооксигеназы обеспечивают
окислительную биотрансформацию
поступающих в организм чужеродных
химических соединений (ксенобиотиков),
а также эндогенных липофильных
биорегуляторных
молекул
 эндобиотиков
(стероидов, арахидонатов, ретиноидов).
эндобиотиков
(стероидов, арахидонатов, ретиноидов).
Содержание цитохрома Р-450 и монооксигеназные активности в печени и других тканях снижаются при развитии бактериальных и вирусных инфекций, иммунизации различными антигенами, в условиях фармакологической иммуностимуляции. Этот эффект опосредован цитокинами. Депримирующее воздействие на цитохром Р-450 зависимые монооксигеназы обнаружено у IFNα, IFNβ, IFNγ, IL 1 и TNF, IL 6, IL 11, IL 2. Цитокины угнетают транскрипцию генов и накопление mRNA различных изоформ цитохрома Р-450 в клетках, возможно и посттранскрипционное угнетение синтеза белка некоторых изоформ. Благодаря цитокиновой модуляции процессов монооксигенирования на цитохроме Р-450, реализуется адаптация механизмов биотрансформации низкомолекулярных ксено- и эндобиотиков в условиях активации иммунной̆ системы («иммунного» стресса). Это обеспечивает, с одной̆ стороны, защиту от последствий возможной неконтролируемой̆ активации потенциально опасной для организма ферментной̆ системы и снижение риска нарушения оксидантного равновесия, с другой сохранение оптимального уровня и неогенез необходимых для адекватного «ответа» организма низкомолекулярных липофильных сигнальных молекул.
