
- •Вопрос 1 Фундаментальные законы химии:
- •Законы стехиометрии:
- •Вопрос 2
- •Классификация:
- •Физические свойства оксидов:
- •Химические свойства оксидов:
- •Взаимодействие с водой
- •Взаимодействие с кислотами
- •Взаимодействие с щелочами
- •Взаимодействие оксидов с восстановителями
- •Получение оксидов
- •Основания
- •Классификация оснований
- •Физические свойства оснований
- •Химические свойства оснований
- •Получение оснований
- •Амфотерные оксиды и гидроксиды
- •Кислоты
- •Физические свойства
- •Химические свойства
- •Отношения к индикаторам
- •Взаимодействие с металлами
- •Физические свойства солей
- •Химические свойства солей
- •Способы получения солей
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
- •По агрегатному состоянию: жидкие, газообразные, твёрдые.
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Номенклатура комплексных соединений
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Буферные растворы, содержащие сильное основание
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Вопрос 46
- •Вопрос 47
- •Вопрос 48
- •Вопрос 49
- •Вопрос 50
- •Вопрос 51
- •Вопрос 52
- •Вопрос 53
- •Вопрос 54
- •Вопрос 55
- •Вопрос 56
- •Вопрос 57
- •Вопрос 58
- •Вопрос 59
- •Вопрос 60
Вопрос 43
Устройства, которые обеспечивают превращение энергия химической реакции в электрическую работу, называются гальваническими элементами. Электрод, находящийся в контакте с окислителем и на котором происходит процесс восстановления, называется катодом, а электрод, находящийся в контакте с восстановителем и на котором происходит процесс окисления, называется анодом.
Электроны во внешней цепи будут двигаться от анода к катоду. Поэтому в гальваническом элементе анод будет иметь отрицательный потенциал или «–», а катод – положительный потенциал или «+». Разность потенциалов катода Eк и анода Eа называется электродвижущей силой (ЭДС) гальванического элемента:
ΔE = Eк − Eа
Рассмотрим гальванический элемент, состоящий из цинкового и медного
электродов (элемент Даниэля – Якоби). Поскольку самопроизвольно электроны могут переходить только от электрода с большей концентрацией электронов к электроду с меньшей концентрацией, то в процессе действия рассматриваемого гальванического элемента электроны во внешней цепи движутся от цинка к меди. На цинковом электроде происходит процесс окисления. Медь в данном случае играет роль инертного электрода, который передает электроны, поступившие от цинка, ионам меди, находящимся в растворе сульфата меди. Таким образом, на медном электроде происходит восстановление катионов меди. Во внутренней цепи сульфат-ионы, оказавшиеся в избытке в катодном пространстве, переходят через пористую перегородку или через солевой мостик в анодное пространство, где компенсируют заряды образовавшихся при окислении ионов цинка.
В основе работы данного гальванического элемента лежит реакция:
Zn + CuSO4 = Cu + ZnSO4
Элемент будет работать до тех пор, пока цинковый анод полностью не раствориться или не восстановиться вся медь из раствора сульфата меди.
Zn – 2e– = Zn2+ - процесс окисления на аноде
Cu2+ + 2e– = Cu - процесс восстановления на катоде
Zn + Cu2+ = Zn2+ + Cu - суммарная реакция
При схематическом изображении гальванического элемента граница раздела между металлом и раствором электролита изображается вертикальной чертой, а граница между растворами электролитов – двойной вертикальной чертой. Например, схема гальванического элемента, в основе работы которого лежит реакция
Zn + 2AgNO3 = Zn(NO3 )2 + 2Ag
изображается следующим образом:
!

Эта же схема может быть изображена в ионной форме:
!
Знаки «–» и «+» электродов и, соответственно, анод и катод находим из сравнения стандартных электродных потенциалов:

 В
В
Стандартный потенциал цинка много меньше, чем серебра, поэтому цинковый электрод будет иметь знак «–» и будет анодом, на котором идет полуреакция окисления металлического цинка:
А!
: Zn −
2 = Zn2+
= Zn2+
а серебряный электрод будет иметь знак «+» и будет катодом, на котором идет полуреакция восстановления ионов серебра:
К+: Ag+ + = Ag
 +
+
где
Pt(H2) обозначает водородный электрод,
состоящий из инертного металла Pt,
выполняющего здесь роль катода, на
котором идет полуреакция восстановления
катионов водорода: K
+:

На аноде протекает полуреакция окисления цинка
А! : Zn − 2e− = Zn2+
Эта же схема элемента в ионной форме будет иметь следующий вид:
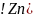 Pt(
+
Pt(
+
