
- •Вопрос 1 Фундаментальные законы химии:
- •Законы стехиометрии:
- •Вопрос 2
- •Классификация:
- •Физические свойства оксидов:
- •Химические свойства оксидов:
- •Взаимодействие с водой
- •Взаимодействие с кислотами
- •Взаимодействие с щелочами
- •Взаимодействие оксидов с восстановителями
- •Получение оксидов
- •Основания
- •Классификация оснований
- •Физические свойства оснований
- •Химические свойства оснований
- •Получение оснований
- •Амфотерные оксиды и гидроксиды
- •Кислоты
- •Физические свойства
- •Химические свойства
- •Отношения к индикаторам
- •Взаимодействие с металлами
- •Физические свойства солей
- •Химические свойства солей
- •Способы получения солей
- •Вопрос 3
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •Вопрос 8
- •Вопрос 9
- •Вопрос 10
- •Вопрос 11
- •Вопрос 12
- •Вопрос 13
- •Вопрос 14
- •Вопрос 15
- •По агрегатному состоянию: жидкие, газообразные, твёрдые.
- •Вопрос 16
- •Вопрос 17
- •Вопрос 18
- •Вопрос 19
- •Вопрос 20
- •Вопрос 21
- •Вопрос 22
- •Вопрос 23
- •Вопрос 24
- •Вопрос 25
- •Вопрос 26
- •Вопрос 27
- •Вопрос 28
- •Номенклатура комплексных соединений
- •Вопрос 29
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Буферные растворы, содержащие сильное основание
- •Вопрос 34
- •Вопрос 35
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 45
- •Вопрос 46
- •Вопрос 47
- •Вопрос 48
- •Вопрос 49
- •Вопрос 50
- •Вопрос 51
- •Вопрос 52
- •Вопрос 53
- •Вопрос 54
- •Вопрос 55
- •Вопрос 56
- •Вопрос 57
- •Вопрос 58
- •Вопрос 59
- •Вопрос 60
Вопрос 21
Степень
электролитической диссоциации
- отношение числа молекул (частиц),
распавшихся на ионы
 ,
к общему числу растворённых молекул
,
к общему числу растворённых молекул


Степень
диссоциации
 может быть выражена
в долях единицы или процентах.
может быть выражена
в долях единицы или процентах.
Электролиты,
у которых
 ,
принято считать сильными, а те, для
которых
,
принято считать сильными, а те, для
которых
 ,
- слабыми. К
сильным электролитам
относятся практически все соли, кислоты:
галогеноводородные (кроме HF),
серная, азотная, хлорная, марганцовая,
хромовая, селеновая, хлорноватая.,
растворимые основания - LiOH,
NaOH,
KOH,
RbOH,
CsOH,
Ca(OH)2,
Sr(OH)2,
Ba(OH)2.
,
- слабыми. К
сильным электролитам
относятся практически все соли, кислоты:
галогеноводородные (кроме HF),
серная, азотная, хлорная, марганцовая,
хромовая, селеновая, хлорноватая.,
растворимые основания - LiOH,
NaOH,
KOH,
RbOH,
CsOH,
Ca(OH)2,
Sr(OH)2,
Ba(OH)2.
Величина степени диссоциации зависит:
От природы растворителя и растворённого вещества.
Концентрации раствора.
Температуры
Вопрос 22
Кажущаяся степень диссоциации - величина с поправкой на межионное взаимодействие. Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
Активность иона - это (доля ионов) концентрация вещества, которая проявляет себя в действии.
Количественные
расчёты характеристик растворов сильных
электролитов осуществляют с помощью
понятий активности
электролита
 ,
и активностей
катионов и анионов
,
и активностей
катионов и анионов
 и
и
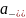 соответственно, которые равны произведению
коэффициента активности на концентрацию.
соответственно, которые равны произведению
коэффициента активности на концентрацию.
Активность иона (моль/л) определяется выражением

Вопрос 23
Процессы диссоциации слабых электролитов равновесны и подчиняются закону действующих масс.
Константа равновесия электролитической диссоциации слабого электролита - количественная характеристика глубины протекания процесса. Она зависит от природы электролита и температуры, не изменяется при изменении начальной концентрации диссоциирующего электролита и введении в раствор других электролитов.


Понятие
 не применяют к процессам диссоциации
сильных электролитов, поскольку их
истинная
степень электролитической диссоциации
близка к единице, в растворе отсутствуют
молекулы электролита, находящиеся в
равновесии с ионами.
не применяют к процессам диссоциации
сильных электролитов, поскольку их
истинная
степень электролитической диссоциации
близка к единице, в растворе отсутствуют
молекулы электролита, находящиеся в
равновесии с ионами.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
Математическое выражение закона разбавления Оствальда имеет вид

Для слабых электролитов, имеющих незначительные величины степени диссоциации, значением в знаменателе можно пренебречь и считать, что 1- =1, тогда
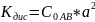
Из
этого следует:

Вопрос 24
При повышении давления химическое равновесие смещается в сторону меньших объемов, при понижении в сторону больших При повышении температуры хим. равновесие смещается в сторону эндотермической реакции -Q, при понижении температуры смещается в сторону экзотермической +Q При повышении концентрации исходных веществ равновесие смещается в сторону продуктов реакции, при понижении в сторону исходных При повышении концентрации продуктов реакции хим. равновесие смещается в сторону исходных веществ, при понижении в сторону продуктов реакции.
