
Электронная структура атомов

|
|
-
Диаграмма уровней энергии
-
Электронная конфигурация
-
Валентные электроны
Квантовые числа используют для описания состояния электрона в атоме. Наряду с квантовыми числами для тех же целей используют:
-
диаграммы уровней энергии атома;
-
электронные конфигурации.
1. Диаграмма уровней энергии

На рисунке показана диаграмма уровней атома, при помощи которой можно описать электроны любого атома.
Из предыдущего материала "Модель атома", думаю, вам все на диаграмме понятно. Единственный нюанс, на который следует обратить внимание: из диаграммы видно, что 4s-орбиталь имеет меньшую энергию, чем 3d-орбиталь (тем самым нарушается правило, согласно которому, слои заполняются электронами по мере увеличения энергии).
Заполняя диаграмму, следует придерживаться следующих несложных правил:
-
сначала электроны заполняют самые низкие из свободных уровней энергии;
-
если конкретный уровень имеет более одного подуровня (для n=3;4…), то каждый из подуровней будет заполняться только одним электроном до тех пор, пока все подуровни этого уровня не будут иметь по 1 электрону. Только после этого эти подуровни будут заполняться вторыми электронами. (Правило Хунда).
Давайте построим диаграмму для хлора (Cl):
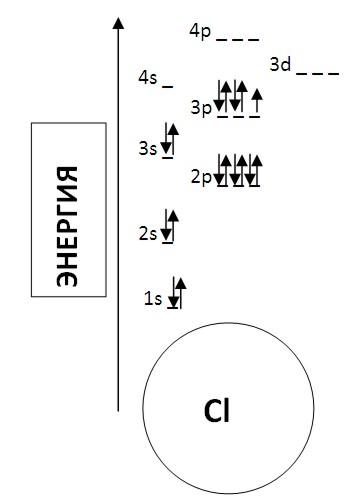
Порядковый номер хлора в таблице - 17. Это значит, что атом хлора содержит 17 протонов и 17 электронов. Т.е., нам на диаграмме надо (согласно правилам) расположить 17 электронов.
Схематически электрон отображается в виде стрелочки. Если на орбитали находятся два электрона, то они отображаются в виде двух разнонаправленных стрелок (электроны с разными спинами).
Сначала заполняем самый низкий энергетический уровень: 1s-орбиталь. На ней размещается 2 электрона. Следующие 2 электрона занимают 2s-орбиталь. Следующий энергетический уровень: 2p-орбиталь - 6 электронов. Следующие 2 электрона - 3s-орбиталь. Оставшиеся 5 электронов располагаются на 3p-орбитали, образуя две спиновые пары (у последнего электрона пары нет).
2. Электронная конфигурация
Все на диаграммах довольно понятно и наглядно, но громоздко. Используя электронную конфигурацию, диаграмму можно выразить одной короткой строкой. Так для хлора: 1s22s22p63s23p5. В электронной конфигурации указывается название орбитали энергетического уровня в верхнем индексе которой находится количество электронов, расположенных на этой орбитали.
|
Сумма чисел, являющихся верхними индексами, равна порядковому номеру атома, т.е., количеству электронов в атоме. |
Немного попрактивовашись вы без труда сможете записывать электронную конфигурацию атома, зная число электронов и принцип заполнения орбиталей.
3. Валентные электроны
Ранее мы говорили, что атом является нейтрально заряженной частицей, поскольку количество электронов и протонов в нем одинаково. Однако, электроны, находящиеся на самых дальних орбиталях, слабо притягиваются положительными протонами, находящимися в ядре атома. Поэтому, атомы элементов способны отдавать и присоединять электроны.
|
Электроны, расположенные на внешнем незавершенном энергетическом уровне, называются валентными электронами. |
К валентным относятся только электроны на s и p-орбиталях.
Теория атома Резерфорда-Бора
Планетарная модель атома Резерфорда
Все вещество состоит из элементарных частиц. Но вещество не состоит из элементарных частиц непосредственно. Кирпичиками или элементами, из которых построено все вещество являются атомы. До 1912 г. ученые представляли атом в виде положительно заряженного шара, внутри которого находятся отрицательно заряженные электроны. Конструкция похожая на кекс с изюминками-электронами была предложена однофамильцами Томсонами – Джозефом Джоном и Уильямом лордом Кельвином.

В целом положительные и отрицательные заряды в таком атоме скомпенсированы и атом электрически нейтрален. Предполагалось, что вся масса атома сконцентрирована в электронах. Поскольку электрон намного легче атома, то даже самые простые атомы должны содержать тысячи электронов.
В 1909 г. Резерфорд поручил молодому тогда еще физику Марсдену исследовать рассеяние альфа лучей при прохождении их через тонкие металлические пластинки. Большинство элементарных частиц испытывали незначительные отклонения после прохождения через пластинки. Однако Марсдену удалось обнаружить и очень сильно отклонившиеся частицы. Их, правда, было очень мало, но удивительно было то, что они вообще были. Конечно, Марсдену могло это показаться. Для регистрации альфа частиц использовался спинтарископ – небольшой прозрачный экран, покрытый специальным флуоресцирующим веществом. Когда элементарная частица попадает в такой экран, возникает слабая вспашка. Вспышка очень маленькая и слабая. Ее наблюдают под микроскопом. Чтобы глаз мог ее заметить, человек должен привыкнуть к темноте. Для этого он, прежде чем начать работать, то есть регистрировать и считать вспышки, должен полчаса посидеть в полной темноте. Вполне естественно поэтому предположить, что Марсден мог ошибиться.
Резерфорд просит Марсдена повторить опыты, но на этот раз специально следить за частицами, получившими большое отклонение вплоть до 90°.
Когда через несколько дней Марсден вошел в кабинет Резерфорда и сказал "есть такие частицы", Резерфорд от удивления выронил трубку. Резерфорд, хотя и предложил Марсдену провести эти опыты, сам не ожидал такого результата.
Резерфорд потом вспоминал: "это было самым невероятным событием моей жизни. Это было почти столь же невероятно, как если бы выстрелили 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился к вам и нанес вам удар".
Опыты снова были перепроверены, но на этот раз к экспериментам подключился Гейгер. Явление было экспериментально изучено и материалы экспериментов опубликованы в том же году. Однако смысл результатов был загадочным. Не мог атом Томсона задержать, летящую с большой скоростью альфа-частицу.
В 1911 г. Резерфорд публикует свою статью "Рассеивание альфа- и бета-частиц веществом и структура атома", в которой предлагает свою знаменитую планетарную модель атома.

Маленькое очень массивное положительно заряженное ядро, от которого как раз и отскакивали альфа-частица в описанных опытах, расположено в центре атома Резерфорда. Вокруг ядра вращаются легкие отрицательно заряженные электроны. Большую часть пространства внутри атома заполняет пустота. В целом модель очень похожа на нашу Солнечную систему.
К великому сожалению Резерфорда, статья была встречена молчанием. Резерфорд, конечно понимал почему. Его атом был недолговечен. Электрон, вращаясь вокруг ядра, должен излучать электромагнитные волны и терять вследствие этого энергию. При этом скорость его должна была бы замедлиться, и он должен был бы упасть на ядро. Однако опыт свидетельствует, что практически все атомы в природе устойчивы.
Выправил ситуацию Нильс Бор.
Теория Бора
Постулаты Бора по своему характеру аналогичны законам Кеплера, которых тоже три. И те и другие являются угаданными закономерностями, полученными на основе экспериментальных фактов. Кеплеру было пожалуй даже труднее. Как, например, можно прийти к результату, что (формула)? Только после того, как Ньютон сформулировал законы механики, законы Кеплера стало возможно объяснить.
Основным недостатком модели Резерфорда было то, что электрон, движущийся по круговой орбите вокруг ядра, должен излучать электромагнитные волны, но факты говорят о том, что он не излучает. Ученые, в том числе и Резерфорд, не могли объяснить этого противоречия. Не мог этого сделать и Бор. Он просто встал на сторону фактов: раз электроны не излучают, значит так и должно быть. Так появился первый постулат. Всего как мы уже сказали их три.
Постулаты Бора
1. Электроны движутся в атоме по стационарным орбитам, при этом они не излучают и не поглощают энергии.
2.
Стационарными орбитами будут те, для
которых момент количества движения
электрона mvr равна
целому кратному ![]() .
.
![]() ,
где k =
1, 2, 3, 4...
,
где k =
1, 2, 3, 4...
3. При переходе с одной орбиты на другую электрон излучает или поглощает энергию в виде фотона.
Находясь
на более далеких орбитах, электрон
обладает большей энергией, поэтому,
переходя на орбиту ближе к ядру, он
излучает один фотон с энергией ![]()

Когда же атом поглощает фотон, электрон может подняться на более высокий уровень.
Размеры атома водорода
Электрон, вращаясь вокруг ядра, испытывает к нему силу кулоновского притяжения:
 ,
где
,
где ![]() –
заряд атомного ядра с порядковым
номером Z.
–
заряд атомного ядра с порядковым
номером Z.
Эта
сила в соответствии со вторым законом
Ньютона должна равняться ![]() ,
следовательно:
,
следовательно:  или
или  .
.
Второй постулат Бора говорит нам о том, что радиус орбиты не может быть произвольным, а должен подчиняться уравнению:
![]() ,
где
,
где ![]() мы
будем обозначать k-ую стационарную
орбиту. Отсюда получаем
мы
будем обозначать k-ую стационарную
орбиту. Отсюда получаем
 .
.
Далее


![]()
 .
.
Мы получили радиус k-ой стационарной орбиты атома с порядковым номером Z. Для водорода Z=1. Найдем радиус первой (k = 1) самой внутренней орбиты, на которой электрон обладает минимальным запасом энергии.
 .
.
Следовательно,
диаметра атома водорода равен примерно ![]() ,
что хорошо согласуется с экспериментальными
данными.
,
что хорошо согласуется с экспериментальными
данными.
Найдем энергию электрона на k-ой орбите.
Его энергия складывается из кинетической энергии движения по орбите и потенциальной электростатической энергии взаимодействия с ядром.
Кинетическая энергия
![]() .
Вспоминая, что
.
Вспоминая, что  ,
получим
,
получим
 .
.
Потенциальная энергия электрона в электростатическом поле ядра
 .
.
Полная энергия электрона
 .
.
В полученное выражение подставим значение для k-ого радиуса орбиты электрона.
 или
окончательно
или
окончательно  .
.
Значение энергии получилось отрицательным. Это означает, что для того, чтобы оторвать электрон от атома, необходимо затратить энергию. Наибольшей по модулю отрицательной энергией электрон обладает на первой боровской орбите.
Когда электрон переходит с k-ой орбиты на n-ную, расположенную ближе к ядру, атом испускает фотон, энергия которого равна разности энергий электрона на этих уровнях. Найдем эту разность энергий.
 .
.
Энергия
фотона ![]() ,
следовательно
,
следовательно
 и
и  .
.
Для
атома водорода Z =
1 и  ,
где R обозначена
величина, которую в спектроскопии
принято называть постоянной Ридберга.
Значение постоянной Ридберга достаточно
точно определено экспериментально и
равно R =
1.097∙107.
,
где R обозначена
величина, которую в спектроскопии
принято называть постоянной Ридберга.
Значение постоянной Ридберга достаточно
точно определено экспериментально и
равно R =
1.097∙107.
Из теории Бора следует, что
 .
.
Теоретический и экспериментальные результаты хорошо согласуются. Следовательно, теория Бора правильно объясняет линейчатый спектр атома водорода.
Однако уже при попытке объяснить строение атома гелия, теория Бора терпит неудачу. На сегодняшний день, как говорят физики, теория Бора имеет лишь историческое значение. Ее сменили более совершенные, но и, к сожалению, более сложные и непонятные теории.
Спектральные серии водорода — набор спектральных серий, составляющих спектр атома водорода. Поскольку водород — наиболее простой атом, его спектральные серии наиболее хорошо изучены. Они хорошо подчиняются формуле Ридберга:
{\displaystyle {\frac {1}{\lambda }}=R\left({\frac {1}{{n'}^{2}}}-{\frac {1}{n^{2}}}\right)},
где R = 109 677 см−1 — постоянная Ридберга для водорода, n′ — основной уровень серии.
Спектральные линии, возникающие при переходах на основной энергетический уровень, называются резонансными, все остальные — субординатными.
Возникновение спектра излучения атома водорода при переходе в состояние с главным квантовым числом, равным одному
Описание
Накаленные твердые тела испускают сплошные спектры. У газов (наряду со сплошной областью) наблюдаются линейчатыеи полосатые спектры. Линейчатый спектр состоит из ряда закономерно расположенных более или менее узких спектральных линий. В полосатом спектре полосы кажутся сплошными при наблюдении в спектроскоп малой разрешающей силы. При применении спектрального аппарата высокой разрешающей силы они распадаются на множество тесно расположенных спектральных линий. К началу 20-го века было выяснено, что линейчатые спектры газов испускаются атомами и ионами, а полосатые — молекулами. Поэтому их называют также атомными и молекулярными спектрами. Атомный спектр водорода удается наблюдать при электрическом разряде в вакуумной водородной трубке только тогда, когда большая часть молекул водорода диссоциировала на атомы. Наиболее характерной чертой атомных спектров оказалась их дискретность – спектры состоят из набора узеньких полосок, соответствующих набору длин волн, вполне определенных для данного вещества (полоски наблюдаются потому, что на входе приземленного или решеточного спектрометра всегда устанавливается узкая вертикальная щель, на которую направляется пучок исследуемого света). Важно отметить, что каждая линия в спектре не представляет собой строго монохроматическую волну, а имеет некоторую конечную ширину.
Линии атомных спектров образуют закономерные группы, называются спектральными сериями. Промежутки между линиями в серии убывают в сторону коротких длин волн, и линии сходятся к границе серии. Наиболее прост спектр атома водорода. Спектральные серии водорода - набор спектральных серий, составляющих спектр атома водорода. Поскольку водород наиболее простой атом, его спектральные серии наиболее изучены. Они хорошо подчиняются формуле Ридберга:

где R = 1.09677*105 см-1 - постоянная Ридберга для водорода, m - уровень с которого переходит атом при излучении, n - уровень серии на который переходит атом.
Серия Лаймана — спектральная серия в спектре атома водорода, названная в честь американского физика Теодора Лаймана, открывшего эту серию в 1916 году. Данная серия образуется при переходах электронов с возбуждённых энергетических уровней на первый в спектре излучения и с первого уровня на все остальные при поглощении. Переход со второго энергетического уровня на первый обозначается греческой буквой α, с 3-го на 1-й — β и т. д. Для обозначения самой серии используется латинская буква L. Таким образом, полное обозначение спектральной линии, возникающей при переходе электрона со второго уровня на первый — Lα (произносится Лайман альфа).
Спектр серии Лаймана

рис.1
Формула Ридберга для серии Лаймана выглядит следующим образом:
![]()
Где n (главное квантовое число) — натуральное число большее 2.
Энергетические уровни в атоме водорода

рис.2
Длины волн серии Лаймана
|
n |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
∞ |
|
Длина волны, нм |
121,6 |
102,5 |
97,2 |
94,9 |
93,7 |
93,0 |
92,6 |
92,3 |
92,1 |
91,9 |
91,15 |
Серия Бальмера – спектральная серия атома водорода, линии которой расположены в видимой и близкой к ультрафиолетовой областях спектра. Эта серия образуется при переходах между состояниями, одно из которых имеет главное квантовое число, равное двум.
Волновые числа n серии Бальмера определяются формулой Бальмера:
![]() ,
,
где n =
3, 4, 5, ..., R – постоянная
Ридберга. Линии серии Бальмера,
получающиеся при n =
3, 4, 5, ..., обозначаются соответственно ![]()
Оптический спектр свободного атома водорода получается при испускании или поглощении электромагнитных волн, что в свою очередь являются следствием переходов между уровнями энергии внешних электронов атома. Состояние атома с минимальной энергией Е1 называется основным. Если атом получит извне некоторое количество энергии, то, в зависимости от ее величины, он может перейти в одно из возбужденных состояний. При этом электрон оказывается на одном из уровней с номерами n = 2, 3, 4,… Такое состояние системы является неустойчивым. Через некоторое время электрон из возбужденного состояния переходит на уровень с меньшим значением энергии. Избыток энергии будет испущен в виде светового кванта. В конечном счете, атом возвращается в основное состояние.
Рис. 1 иллюстрирует образование спектральных серий атома водорода при переходе электрона с высоких стационарных орбит на более низкие.
Стационарные орбиты атома водорода и образование спектральных серий
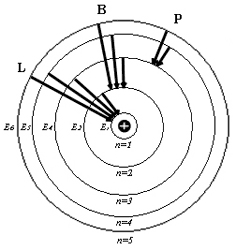
Рис. 1
L – серия Лаймана, B – серия Бальмера, P – серия Пашена
На рис. 2 изображена диаграмма энергетических уровней атома водорода и указаны переходы, соответствующие различным спектральным сериям. Для первых пяти линий серии Бальмера в видимой части спектра указаны длины волн.
Энергетические уровни атома водорода

Рис. 2
L – серия Лаймана, B – серия Бальмера, P – серия Пашена , Br – серия Брэкета, Pf – серия Пфунда
Благодаря распространенности водорода во Вселенной серия Бальмера наблюдается в спектрах большинства космических объектов.
Анализ интенсивностей линий серии Бальмера позволяет судить о температурах звезд, так как для получения интенсивных линий необходимо, чтобы в их образовании участвовало достаточное количество неионизованных возбужденных атомов водорода. Такие условия выполняются в атмосферах звезд спектрального класса А с температурой T~104 К (в более холодных звездах мало возбужденных атомов водорода, а в горячих звездах почти все атомы водорода ионизованы). Сравнивая контуры линий серии Бальмера, получают информацию о плотностях звездных атмосфер.
Бальмер (Balmer) Иоганн Якоб (1825–1898), швейцарский физик и математик, эмпирически установил (1885), что длины волн видимой части спектра атома водорода связаны между собой простой зависимостью (1), позволяющей определить длины волн всех линий спектральной серии водорода. Серия Бальмера была впервые обнаружена в спектре Солнца.
