
Основы наноелектроники / Основы наноэлектроники / ИДЗ / Книги и монографии / ДНК наномеханические роботы и вычислительные устройства (Попов), 2008, c.210
.pdf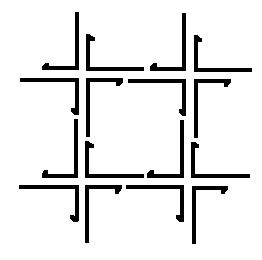
Рис.6. Нанорешетка, составленная из четырех 3-6 рук.
Для регулировки плотности расположения молекул T и T‘ в пространстве можно использовать различные методы для создания самоорганизующихся систем независимых структур. Например, методы, основанные на генетических алгоритмах или искусственных иммунных системах. Другую возможность дает использование вирусов или нанорешеток в качестве доков. Экспериментально синтезированной нанорешетки, пригодной для выполнения функций дока, пока нет. Однако поставленные к настоящему времени эксперименты показывают, что подобная конструкция принципиально возможна. В частности, за модельную основу можно взять конструкцию куба, состоящего из шести стенок и каркаса. Для стенок дока можно,
например, использовать нанорешетку, составленную из 3-6 рук, предложенную в [1117]
(см. рисунки 5 и 6). Можно также использовать нанорешетку, построенную по той же схеме, что и нанорешетка на рисунке 6, но с использованием других наноузлов.
Например, можно использовать наноузлы, предложенные в работе [1118] (см. рисунок
7). Отметим, что нанорешетка по типу представленной на рисунке 6 с наноузлами,
изображенными на рисунке 7, экспериментально конструировалась (см. [1092], см.
также [1089]). Размер одной клетки составляет менее 30 nm в одном измерении.
Существует технология программирования клеток этой решетки, которая позволяет, в
частности, снизить проницаемость клеток (см. [1119]). Следует также отметить, что
71
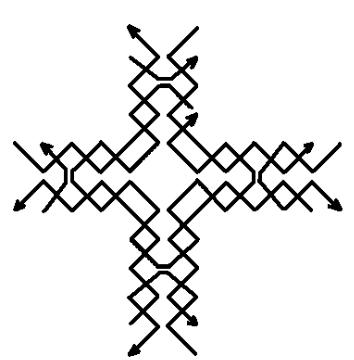
наноузлы, изображенные на рисунке 7 имеют четыре последовательности ДНК в сечении на протяжении всей конструкции и на каждом из четырех концов (в отличие от двух у 3-6 руки), что существенно облегчает сцепление полученной из них нанорешетки с другими структурами (см., в частности, [1094]).
Рис.7. Конструкция наноузла, предложенная в [1118]. С геометрической точки зрения этот наноузел составлен из девяти последовательностей ДНК и получен наложением четырех последовательностей ДНК, изображенных на рисунке 8.а, и
пяти последовательностей ДНК, изображенных на рисунке 8.б.
72
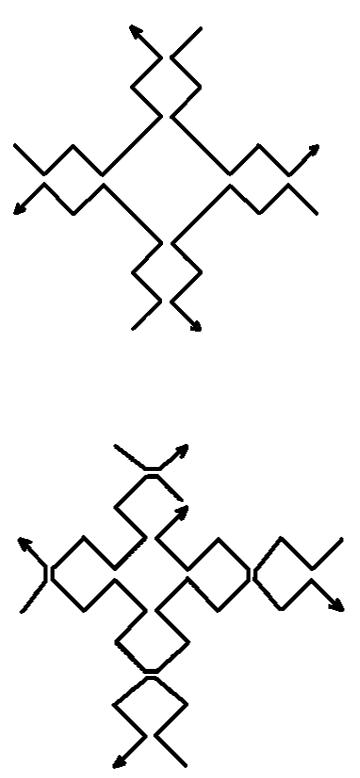
Рис.8.а. Конструктивные элементы нанорешетки, изображенной на рисунке 7.
Рис.8.б. Конструктивные элементы нанорешетки, изображенной на рисунке 7.
73

В качестве остова для конструкции дока можно рассмотреть нанорешетку кубической формы (см., например, [1120]). Например, конструкцию, представленную на рисунке 9.
Рис.9. Нанорешетка в форме куба.
74
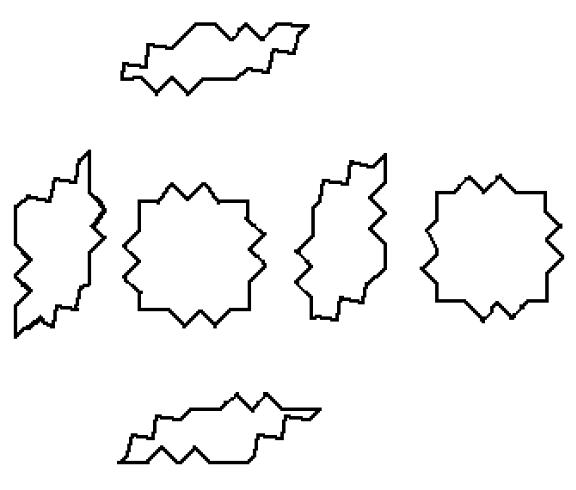
Рис.10. Конструктивные элементы нанорешетки, изображенной на рисунке 9.
Еще один подход к организации взаимодействия между молекулами заключается в создании синтетических генных регуляторных сетей, искусственных биологических систем и генетических булевых автоматов, т.е. схем, в рамках которых взаимодействие между генетическими последовательностями поддерживается при помощи простейших устройств (см., например, [1121] – [1149]).
Одна из ключевых проблем нанотехнологий in vivo – распространение процессов между клетками. Хотя на внутриклеточном уровне успехи нанотехнологий довольно существенны, большинство разрабатываемых роботов неспособны перемещаться между клетками. В то же время многие важные для живых систем задачи могут быть решены только при наличии межклеточного взаимодействия. Кроме того,
75
весьма заманчиво выглядит идея размещения наноробота лишь в одной клетке после чего он сам обеспечит свое размножение и распространение по многоклеточному организму.
Один из подходов к решению этой проблемы заключается в использовании вирусов и бактерий в качестве носителей нанороботов. Кроме того, для обеспечения перемещения между клетками и межклеточного обмена сигналами можно попытаться использовать гибридные и неорганические нанороботы. Одним из ключей к решению этой проблемы могут стать коллективные ритмы многоклеточных систем. Феномен коллективных ритмов наблюдается у живых организмов на всех уровнях (см.,
например, [1150] – [1154]). Период коллективных ритмов может колебаться от доли секунды до нескольких лет. Предложено несколько моделей и теорий, объясняющих феномен коллективных ритмов (см. [1151], [1155] – [1172]). Особое направление составляют вопросы исследования коллективных ритмов подвижных клеток (см.
[1158], [1162], [1163], [1168], [1171]). Доказано, что межклеточные сигналы в популяции клеток существенны для глобального обмена информацией как у прокариотов, так и у эукариотов (см. [1173], [1174]). Однако сигнальные системы многоклеточных и одноклеточных организмов существенно отличаются (см. [1156], [1172], [1175]). С точки зрения возможности управления межклеточным обменом информацией представляет интерес тот факт, что у всех подвижных клеток межклеточный обмен информацией осуществляется при помощи специальных сигнальных молекул (см. [1158], [1162], [1163], [1168]).
Литература
1.Liu Y., Flood A.H., Bonvallet P.A., Vignon S.A., Northrop B.H., Tseng H.-R., Jeppesen J.O., Huang T.J., Brough B., Baller M., Magonov S., Solares S.D., Goddard W.A., Ho C.-M., Stoddart J.F. // J. Am. Chem. Soc. 2005. V.127. P.9745.
2.Berna J., Leigh D.A., Lubomska M., Mendoza S.M., Perez E.M., Rudolf P., Teobaldi G., Zerbetto F. // Nat. Mater. 2005. V.4. P.704.
3.Eelkema R., Pollard M.M., Vicario J., Katsonis N., Ramon B.S., Bastiaansen C.W.M., Broer D.J., Feringa B.L. // Nature. 2006. V.440. P.163.
76
4.Schoevaars A. M. et al. Toward a switchable molecular rotor // J. Org. Chem. 1997. V.62. P.4943-4948.
5.Koumura N., Zijlstra R.W.J., van Delden R.A., Harada N., Feringa B.L. Lightdriven monodirectional molecular rotor // Nature. 1999. V.401. P.152-155.
6.Pollard M.M., Klok M., Pijper D., Feringa B.L. Rate Acceleration of Light-Driven Rotary Molecular Motors // Adv. Funct. Mater. 2007. V.17. P.718–729.
7.Yang X., Wenzler L.A., Qi J., Li X., Seeman N.C. Ligation of DNA Triangles Containing Double Crossover Molecules // Journal of the American Chemical Society. 1998. V.120. P.9779-9786.
8.Seeman N.C. DNA Nicks and Nodes and Nanotechnology // NanoLetters. 2001. V.1. P.22-26.
9.Clayden J., Pink J. H. Concerted rotation in a tertiary aromatic amide: towards a simple molecular gear // Angew. Chem. Int. Edn Engl. 1998. V.37. P.1937-1939.
10.Huck N.P.M., Jager W.F., de Lange B., Feringa B.L. Dynamic control and amplification of molecular chirality by circularly polarized light // Science. 1996. V.273. P.1686-1688.
11.Beyer S., Nickels P., Simmel F.C. Periodic DNA Nanotemplates Synthesized by Rolling Circle Amplification // NanoLetters. 2005. V.5. P.719-722.
12.Bissell S. A., Cordova E., Kaifer A. E., Stoddart J.F. A chemically and electrochemically switchable molecular shuttle // Nature. 1994. V.369. P.133-136.
13.Balzani V., Credi A., Raymo F.M., Stoddart J.F. // Angew. Chem. Int. Ed. 2000. V.39. P.3348.
14.Special Issue on Molecular Machines. Acc. Chem. Res. 2001. V.34.
15.Special Volume on Molecular Machines and Motors. Struct. Bond. 2001. V.99.
16.Balzani V., Credi A., Venturi M. Molecular Devices and Machines—A Journey into the Nano World. Wiley-VCH, Weinheim, 2003.
17.Elizarov A.M., Chiu S.H., Stoddart J.F. // J. Org. Chem. 2002. V.67. P.9175.
18.Tseng H.R., Vignon S.A., Stoddart J.F. // Angew. Chem. Int. Ed. 2003. V.42. P.1491.
19.Keaveney C.M., Leigh D.A. // Angew. Chem. Int. Ed. 2004. V.43. P.1222.
20.Leigh D.A., Perez E.M. // Chem. Comm. 2004. P.2262.
77
21.Ashton P.R., Ballardini R., Balzani V., Baxter I., Credi A., Fyfe M.C.T., Gandolfi M.T., Gomez-Lopez M., Martinez-Diaz M.V., Piersanti A., Spencer N., Stoddart J.F., Venturi M., White A.J.P., Williams D.J. Acid-base controllable molecular shuttles // J. Am. Chem. Soc. 1998. V.120. P.11932-11942.
22.Tseng H.R., Vignon S.A., Celestre P.C., Perkins J., Jeppesen J.O., Di Fabio A., Ballardini R., Gandolfi M.T., Venturi M., Balzani V., Stoddart J.F. // Chem. Eur. J. 2004. V.10. P.155.
23.Altieri A., Gatti F.G., Kay E.R., Leigh D.A., Martel D., Paolucci F., Slawin A.M.Z., Wong J.K.Y. // J. Am. Chem. Soc. 2003. V.125. P.8644.
24.Willner I., Pardo-Yssar V., Katz E., Ranjit K.T. // J. Electroanal. Chem. 2001. V.497. P.172.
25.Wang Q.C., Qu D.H., Ren J., Chen K.C., Tian H. // Angew. Chem. Int. Ed. 2004. V.43. P.2661.
26.Abraham W., Grubert L., Grummt U.W., Buck K. // Chem. Eur. J. 2004. V.10. P.3562.
27.Bedard T.C., Moore J.S. Design and synthesis of a ―molecular turnstile‖ // J. Am. Chem. Soc. 1995. V.117. P.10662-10671.
28.Kelly T.R., Tellitu I., Sestelo J.P. In search of molecular ratchets // Angew. Chem. Int. Ed. Engl. 36, 1866-1868 (1997).
29.Yurke B., Turberfield A.J., Mills A.P., Simmel F.C., Neumann J.L. A DNAfuelled molecular machine made of DNA // Nature. 2001. V.415. P.62–65.
30.Simmel F.C., Yurke B. A DNAbased molecular device switchable between three distinct mechanical states // Appl. Phys. Lett. 2002. V.80. P.883–885.
31.Mitchell J.C., Yurke B. DNA scissors // DNA Computing. Proc. 7th Int. Meet. DNA-Based Computers, ed. S.N.Jonoska, N.Seeman. Univ. So. FL, Tampa. Heidelberg: Springer Verlag, 2002.
32.Badjic J.D., Balzani V., Credi A., Silvi S., Stoddart J.F. // Science. 2004. V.303. P.1845.
33.Persson B., Stenhag K., Nilsson P., Larsson A., Uhlen M., Nygren P. Analysis of oligonucleotide probe affinities using surface plasmon resonance: a means for mutational scanning // Anal. Biochem. 1997. V.246. P.34-44.
78
34.Sauer M., Brecht A., Charisse K., Maier M., Gerster M., Stemmler I., Gauglitz G., Bayer E. Interaction of chemically modified antisense oligonucleotides with sense DNA: a label-free interaction study with reflectometric interference spectroscopy // Anal. Chem. 1999. V.71. P.2850-2857.
35.Peterson A.W., Wolf L.K., Georgiadis R.M. Hybridization of mismatched or partially matched DNA at surfaces // J. Am. Chem. Soc. 2002. V.124. P.14601-14607.
36.Nelson B.P., Grimsrud T.E., Liles M.R., Goodman R.M., Corn R.M. Surface plasmon resonance imaging measurements of DNA and RNA hybridization adsorption onto DNA microarrays // Anal. Chem. 2001. V.73. P.1-7.
37.Watts H.J., Yeung D., Parkes H. Real-time detection and quantification of DNA hybridization by an optical biosensor // Anal. Chem. 1995. V.67. P.4283-4289.
38.Wang J. Electrochemical nucleic acid biosensors // Anal. Chim. Acta. 2002. V.469. P.63-71.
39.Hook F., Ray A., Norden B., Kasemo B. Characterization of PNA and DNA immobilization and subsequent hybridization with DNA using acoustic-shear-wave attenuation measurements // Langmuir. 2001. V.17. P.8305-8312.
40.Yu F., Yao D., Knoll W. Oligonucleotide hybridization studied by a surface plasmon diffraction sensor (SPDS) // Nucleic Acids Res. 2004. V.32. P.75-81.
41.Backmann N., Zahnd C., Huber F., Bietsch A., Pluckthun A., Lang H., Guntherodt H., Hegner M., Gerber C. A label-free immunosensor array using single-chain antibody fragments // Proc. Natl. Acad. Sci. USA. 2005. V.102. P.14587–14592
42.Fritz J., Cooper E.B., Gaudet S., Sorger P.K., Manalis S.R. Electronic detection of DNA by its intrinsic molecular charge // Proc. Natl. Acad. Sci. USA. 2002. V.99. P.14142–14146.
43.Gfeller K.Y., Nugaeva N., Hegner M. Rapid Biosensor for Detection of Antibiotic-Selective Growth of Escherichia coli // Applied and Environmental Microbiology. 2005, V.71. P.2626–2631.
44.Fritz J., Baller M.K., Lang H.P., Rothuizen H., Vettiger P., Meyer E., Guntherodt H.J., Gerber C., Gimzewski J.K. Translating biomolecular recognition into nanomechanics // Science. 2000. V.288. P.316-318.
79
45. Liu W., Montana V., Chapman E.R., Mohideen U., Parpura V. Botulinum toxin type B micromechanosensor // Proc. Natl. Acad. Sci. USA. 2003. V.100. P.13621– 13625.
46.McKendry R., Zhang J., Arntz Y., Strunz T., Hegner M., Lang H., Baller M.K., Certa U., Meyer E., Guntherodt H., Gerber C. Multiple label-free biodetection and quantitative DNA-binding assays on a nanomechanical cantilever array // Proc. Natl. Acad. Sci. USA. 2002. V.99. P.9783–9788.
47.Lang H.P., Berger R., Andreoli C., Brugger J., Despont M., Vettiger P., Gerber C., Ramseyer J.P., Meyer E., Guntherodt H.-J. Sequential position readout from arrays of micromechanical cantilever sensors // Appl. Phys. Lett. 1998. V.72. P.383–385.
48.Cornell B.A. et al. // Nature. 1997. V.387. P.580.
49.Boon E.M., Ceres D.M., Drummond T.G., Hill M.G., Barton J.K. // Nature Biotechnol. 2000. V.18. P.1096.
50.Gu L.-Q., Cheley S., Bayley H. // Science. 2001. V.291. P.636.
51.Willner I., Katz E. // Angew. Chem. Int. Ed. 2000. V.39. P.1180.
52.Schutz S. et al. // Sens. Actuators B. 2000. V.65. P.291.
53.Gopel W. // Sens. Actuators B. 1998. V.52. P.125.
54.Marvin J.S. et al. // Proc. Natl. Acad. Sci. USA. 1997. V.94. P.4366.
55.Marvin J.S., Hellinga H.W. // J. Am. Chem. Soc. 1998. V.120. P.7.
56.Marvin J.S., Hellinga H.W. // Proc. Natl. Acad. Sci. USA. 2001. V.98. P.4955.
57.Cheng Q., Stevens R.C. // Adv. Mater. 1997. V.9. P.481.
58.Shen Y., Safinya C.R., Liang K.S., Ruppert A.F., Rothschild K.J. // Nature. 1993. V.366. P.48.
59.Tang Y., Dave B.C. // Adv. Mater. 1998. V.10. P.1536.
60.Chemla Y.R. et al. // Proc. Natl. Acad. Sci. USA. 2000. V.97. P.14268.
61.Edlestein R.L. et al. // Biosens. Bioelectron. 2000. V.14. P.805.
62.Balzani V., Credi A., Raymo F.M., Stoddart J.F. // Angew. Chem. Int. Ed. 2000. V.39. P.3348.
63.Feringa B.L., van Delden R.A., Koumura N., Geertsema E.M. // Chem. Rev. 2000. V.100. P.1789.
80
