

КРИСТАЛЛЫ И АМОРФНЫЕ ВЕЩЕСТВА
Существующие в природе вещества могут находиться в одном из четырех агрегатных состояний: твердом, жидком,
газообразном или плазменном.
Твердые тела могут быть кристаллическими или аморфными (стеклообразными). Для кристаллического строения характерно наличие дальнего порядка, т. е. периодичности повторения присущей данному материалу элементарной группы атомов (на больших расстояниях), для аморфного – характерно наличие ближнего порядка, т. е. упорядоченности в расположении лишь близлежащих частиц.
Монокристаллические тела (монокристаллы), для которых
характерен |
дальний |
порядок |
структуры, |
обладают |
анизотропией свойств.
Поликристаллы, состоящие из множества беспорядочно ориентированных монокристаллитов, а также аморфные тела
изотропны.
31
Л2 АТОМНАЯ СТРУКТУРА И ЭЛЕМЕНТЫ
МЕЖАТОМНЫЕ СВЯЗИ, МОЛЕКУЛЫ
•Все вещества состоят из атомов. Хотя атомы очень малы и имеют радиус обычно 10-10 м (или 1 Ǻ), они весьма сложны по структуре. Атом состоит из ядра, содержащего протоны и нейтроны, и вращающихся вокруг него электронов. Протоны и нейтроны имеют примерно равную массу. Протоны заряжены положительно, а нейтроны электрически нейтральны. Количество электронов вокруг ядра равно количеству
протонов, заряжены они отрицательно. Большинство электронов, связанных с каким-либо атомом, крепко удерживаются электростатической силой около ядра. Они могут считаться внутренними электронами и находиться на низких энергетических уровнях. Внешние электроны, называемые валентными, обладают большим количеством энергии и не столь прочно
связаны с ядром. Именно они важны для изменения |
|
свойств вещества. |
1 |
•Атом может иметь от 0 до 7 валентных электронов, и именно это количество определяет группу атомов в периодической системе элементов, к которой принадлежит данный атом. Группы в таблице представлены колонками, все элементы внутри группы имеют одно и то же число валентных электронов.
•Так как именно валентные электроны обладают значительной энергией, то они и определяют поведение атома при взаимодействии с другими атомами. Стремление к снижению потенциальной энергии электронов влияет на это поведение. Так, при формировании молекулы каждый атом либо стремится потерять свой валентный электрон, либо его приобрести, чтобы завершить свою электронную оболочку.
2
•Элементы, которые находятся справа в периодической таблице, имеют большое количество электронов на внешней оболочке и им необходимо несколько дополнительных электронов для завершения своей внешней оболочки, чтобы она стала стабильной.
•Атомы хлора, например, имеют семь валентных электронов, и, следовательно, для заполнения внешнего электронного слоя им необходим только один электрон. Если два атома хлора соединяются, то два электрона, один от каждого атома, образуют пару (рис. 1.3). После такой комбинации каждый электрон в паре может принимать участие в образовании структуры каждого атома. Таким образом, как и требуется, каждый атом будет иметь по восемь электронов на внешней электронной оболочке. Этот процесс взаимодействия электронов называется ковалентным.
3

Рис.1.3. Ковалентная связь в молекуле хлора [6
Возникшая таким образом молекула имеет два атома. Подобные ковалентные связи образуют также водород,
кислород.
4
•Элементы, расположенные в левой части таблицы, имеют небольшое количество валентных электронов: натрий — один, бериллий — два, алюминий — три и т. д.
•Этим атомам, легче отдать электроны для образования стабильной конфигурации на внешнем электронном слое, чем присоединить их. Каждый атом освобождается от своих валентных электронов, которые образуют «электронное облако». Алюминий теряет три электрона, составляя структуру, содержащую ядро и внутреннюю завершенную электронную оболочку. Электрически не сбалансированные структуры, остающиеся в результате этого, называются ионами, они положительно заряжены, так как преобладают протоны над электронами. Вещество существует как структура положительно заряженных ионов, окруженных «электронными облаками» — свободными электронами. Такие вещества называются металлами (рис.1.4). Общие электростатические связи, которые существуют между ионами и электронами и удерживают ионы вместе, называются металлическими связями. Очень мало веществ, состоящих только из
атомов одного и того же типа. |
5 |
|

металлическая связь в металлах
Рис 1.4. Атомная структура металла
6
•Имеется еще один вид первичных межатомных связей, когда соединяются атомы элементов из различных мест таблицы. Классическим примером такого соединения является соединение натрия и хлора. Натрий имеет избыток валентных электронов в каждом атоме, а хлор — недостаток для получения завершенной электронной оболочки. Атом натрия поэтому отдает свой единственный валентный электрон атому хлора, и они образуют стабильную конфигурацию (рис. 1.5). В результате появляется положительный ион натрия и отрицательный ион хлора, между которыми имеется сильное электростатическое взаимодействие. Такая связь называется ионной. Примером ионных связей являются соединения такие, как окиси, сульфиды, фториды, хлориды и т. д.
7
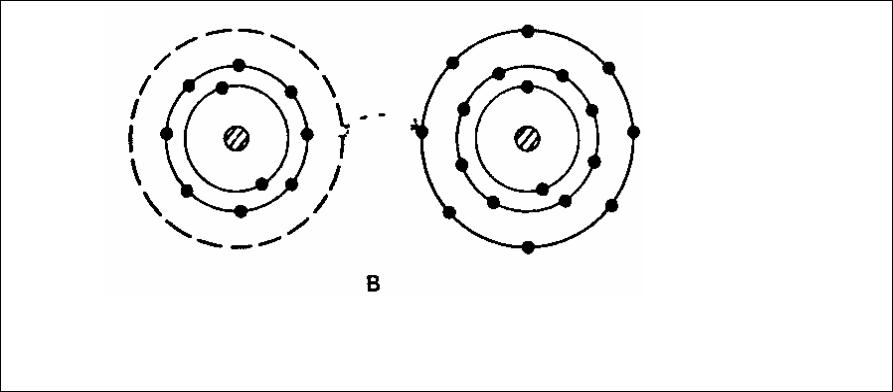
Ионная связь (положительный ион натрия и отрицательный ион хлора
Рис. 1.5. Ионная структура молекулы хлорида натрия
8
•Очень мало веществ, содержащих ковалентные связи, являются прочными в связи со слабыми силами сцепления. Чтобы вещество было твердым и прочным, необходимо, чтобы оно имело прочные связи и внутри молекул.
•Металлические связи отличаются от ковалентной тем, что не имеют пространственной направленности. Не обязательно, чтобы два соседних атома непосредственно соединялись друг с другом, просто диффузное электронное облако взаимодействует со скоплением положительных ионов. Здесь также отсутствуют слабые межмолекулярные связи, которые могут снижать прочность структуры, и в целом металлические связи достаточно сильны, чтобы образовывать твердое тело при комнатной температуре. Однако у некоторых металлов температура плавления лишь ненамного выше комнатной температуры. Только ртуть существует в естественных условиях в виде жидкости.
9
