
- •Лекция 2 Сорбционные методы разделения и концентрирования
- •1. Общая характеристика. Особенности сорбции как метода разделения и концентрирования.
- •2. Особенности физической и химической сорбции. Концентрирование в статических и динамических условиях
- •3. Количественное описание сорбции
- •4. Химико-аналитические свойства сорбентов
- •5. Примеры использования комплексообразующих сорбентов для выделения и концентрирования неорганических и органических соединений
- •5.1. Сорбционные методы разделения и концентрирования в фарманализе
4. Химико-аналитические свойства сорбентов
К химико-аналитическим свойствам сорбентов относят(СЛАЙД13)
- степень сорбции (R, %)
коэффициент концентрирования
pHопт.
сорбционная емкость сорбента (СЕС)
активность сорбента;
время и температура сорбции.
(СЛАЙД 14)
Степень сорбции показывает, какая доля абсолютного количества микроэлемента содержится в концентрате:
R = qк / qпр
где qк и qпр– абсолютные количества микроэлемента в концентрате и пробе соответственно.
Коэффициент концентрирования Кпоказывает, во сколько раз изменилось соотношение абсолютных масс микроэлемента и матрицы в концентрате по сравнению с пробой.
К
=
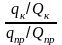 =R
=R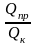
где Qк и Qпр– абсолютные массовые количества матрицы в концентрате и пробе соответственно.
СЛАЙД 15
Сорбционная емкость сорбента (СЕС мг/г) показывает максимально возможное количество элемента, способное извлекаться данным сорбентом при оптимальных условиях.
pHопт. показывают наиболее благоприятную кислотность среды при которой степень сорбции максимальна.
4.2. Статическая и динамическая активность адсорбентов.
Основной характеристикой адсорбента является его активность, определяемая весовым количеством вещества, поглощенного единицей объема или веса поглотителя.
Статическая активность адсорбента характеризуется максимальным количеством вещества, адсорбированного к моменту достижения равновесия весовой или объемной единицей адсорбента при данной температуре и концентрации адсорбируемого вещества в газо-воздушной смеси.
Динамическая активность является характеристикой адсорбента при протекании паровоздушной смеси через слой адсорбента до момента проскока адсорбируемого газа.
Если газовая смесь проходит через слой адсорбента, то в начальный период процесса адсорбтив полностью извлекается из газовой смеси. По истечении определенного промежутка времени в газовой смеси, уходящей из поглотителя, начинают появляться заметные, все возрастающие количества адсорбтива (проскок), и к концу процесса концентрация уходящего газа становится равной начальной концентрации паровоздушной смеси.
4.3. Селективные свойства сорбентов.
В процессах адсорбции, так же как и в процессах абсорбции, поглощающие вещества адсорбенты обладают селективными свойствами по отношению к поглощаемым газам и парам. Иными словами, применение адсорбционных процессов в качестве метода разделения газовых смесей основано на том, что газовая смесь, приведенная в соприкосновение с адсорбентом, освобождается лишь от одного компонента, в то время как другие оказываются непоглощенными.
Если в процессах абсорбции селективные качества процесса определялись растворимостью или нерастворимостью газа в поглощающей жидкости, то в процессах адсорбции критерием селективных качеств является статическая активность адсорбента.
Из смеси газов, приведенных в соприкосновение с адсорбентом, в первую очередь и в значительно большем количестве поглощается газ или пар того вещества, которое имеет более высокую температуру кипения. В большинстве случаев температура кипения поглощаемого газа (например, паров бензола) сильно отличается от температуры кипения инертного газа (например, воздуха) и присутствие инертного газа почти не оказывает влияния на ход процесса. В данном случае поглощение бензола из паровоздушной смеси с парциальной упругостью паров бензола р протекает точно так же, как и поглощение чистых паров бензола, имеющих то же давление.
Разделение адсорбционным методом смеси газов, компоненты которой имеют близко лежащие температуры кипения, предоставляет большие трудности или практически невозможно.
Синтетические иониты
Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы.
Ионообменными смолами называются искусственные органические высокомолекулярные соединения, обладающие ионообменными свойствами.
Иониты разделяются на катиониты, поглощающие катионы, и аниониты, поглощающие анионы. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. В зависимости от природы матрицы различают неорганические и органические иониты.
По «пористости» синтетические иониты можно разделить на гелевые (непористые) и макропористые. В гелевых ионитах поры, как таковые, отсутствуют. Доступность ионообменных групп обеспечивается набуханием ионита, в результате чего в материале образуется пористость. Макропористые иониты получают введением в массу порообразователя – инертного растворителя в процессе синтеза (например, высших углеводородов и спиртов). Часть растворителя задерживается в матрице и после его удаления из гранул получаются смолы с развитой внутренней поверхностью в ненабухшем состоянии и большим объемом пор. Макропористые иониты мало набухают, но благодаря развитой пористой поверхности, очень активны в обменных процессах. Удельная поверхность таких ионитов составляет от 20 до 130 м2/г. Диаметр пор макропористых ионитов варьирует от 200 до 1000 A.
Активные угли- пористое углеродное вещество, обладающее высокими адсорбционными свойствами и гидрофобностью. Cпособность AУ поглощать (адсорбировать) газы, пары и растворённые вещества обусловлена их развитой перовой поверхностью c большим числом так называемых активных центров.
Их получают при действии на неактивные паров Н2О или СО2 при 850—950 °С. При этом часть угля выгорает и получается активный уголь, пронизанный весьма тонкими порами с радиусом менее 1 нм. Поверхность покрыта главным образом оксидными группами, причем из-за неоднородности состава оксидов на поверхности физическая адсорбция может сопровождаться как катионо-, так и анионообменными процессами. Особо активными центрами на поверхности являются ребра и углы кристаллитов. Особое место занимают окисленные активные угли, являющиеся селективными полифункциональными катионообменниками. Они весьма устойчивы к химическим, термическим и радиационным воздействиям, их легко получить и регенерировать.
Для объяснения механизма адсорбции на углях предложено несколько теорий, предполагающих действие Ван-дер-ваальсовых сил, образование химических комплексов, электрохимическое взаимодействие.
Обычный активный уголь хорошо поглощает сильные кислоты и не поглощает щелочи, окисленный - наоборот. Активные угли используют в качестве эффективных сорбентов для извлечения свинца из атмосферного воздуха; Са, Ва и Sr из концентрированных растворов щелочей, солей и других соединений; Сг, Мо и V из воды и рассолов ртутного электролиза. Как правило, определение элементов заканчивается непосредственно в концентрате: прямым сжиганием концентрата в канале спектрального угольного электрода или концентрат облучают потоком нейтронов или определяют элементы в концентрате рентгенофлуоресцентным методом. Окончание анализа может быть другим: после разложения сорбента, содержащего сорбированные компоненты, действием азотной кислотой в полученном растворе компоненты определяют атомно-абсорбционным, спектрофотометрическим и другими методами.
Неорганические ионообменники:
Различают неорганические и органические ионообменники. Природные минеральные ионообменники представляют собой, как правило, кристаллические алюмосиликаты (наиболее важными представителями этой группы являются цеолиты).
Синтетические неорганические ионообменники получают на основе алюмосиликатов. Этот тип ионообменников называют пермутитами, их состав отвечает общей формуле Al2О3-nSiО2-mNa2О-pH2О.
При определении следов элементов часто используют ионообменную целлюлозу и синтетические неорганические ионообменники на основе чистых соединений вольфрамат, молибдат циркония, оксиды Zr (IV), Th (IV), Ti (IV) и Sn (IV)).
После освоения производства синтетических ионообменных органических смол сфера применения неорганических ионообменников существенно сократилась.
Синтетические органические ионообменники представляют собой продукты полимеризации и поликонденсации непредельных органических соединений, содержащих кислотные (-SO3H, -COOH, -ОН и др.) или основные (- N(CH3)3 +, - NH3 +, =NH2 + и др.) группы. Ионообменники с кислотными группами способны обменивать катионы и называются катионообменниками (катиониты). Сорбенты с основными группами обменивают анионы — это анионообменники (аниониты). Амфолиты - иониты, содержащие закрепленные кислотные и основные группы и в определенных условиях выступающие либо как катиониты, либо как аниониты.
Ионообменники можно приготовить в виде мелкозернистого порошка, волокон, тканей, мембран и бумаги, макропористых гранул. Иногда мелкие зерна сорбентов вносят в массу какого-либо инертного материала (так называемый наполненный сорбент) или наносят сорбент в виде тонкого слоя на поверхность шарика из другого материала.
Сорбция ионов происходит в результате их диффузии внутрь частиц смолы, а также адсорбции и электростатических взаимодействий. Таким образом, селективность сорбции ионов одного и того же заряда, возможно, будет определяться преобладающим типом сорбции. Следовательно, при доминировании электростатических взаимодействий селективно сорбироваться будут ионы, характеризующиеся высоким отношением заряда к радиусу сольватированной формы иона. При сорбции легко поляризующихся ионов ион с большим радиусом будет обладать более высокой обменной способностью. Если размеры ионов отличаются друг от друга, то разделение может основываться на различной способности проникновения ионов в структуру ионообменника.
СЛАЙД 16
Ионообменный процесс можно представить следующими уравнениями:
2R-SO3H + Ca2+ = (R-SO3)2Ca + 2H+ (катионныйобмен)
2R-N(CH3)3C1+SO42- = [R-N(CH3)3]2SO4+2Cl-(анионныйобмен)
В общем виде равновесие можно написать, например, для катионного обмена
R-(X)+ +Y+ = R-(Y)++X+
тогда константа обмена будет иметь вид
K = [(Y+)][X+] / [(X)+][Y+]
Известно несколько подходов к описанию ионообменных равновесий. Наиболее часто используются теоретические концепции, базирующиеся на применении закона действующих масс или мембранного распределения. Оба подхода к описанию ионообменного равновесия не являются строгими.
С практической точки зрения необходимо признать, что ионный обмен не очень селективный процесс. Чаще разделение на ионообменниках проводят путем изменения форм нахождения ионов в растворе, варьируя рН раствора или вводя комплексообразующие вещества, связывающие ионы в комплексы. Например, в щелочных растворах на анионообменниках алюминии, который в этом растворе существует в виде комплекса А1(ОН)4, можно отделить от щелочно-земельных элементов. Из солянокислых сред Ni(II), Al(III), Y(III), Th(IV) не сорбируются анионообменниками, поскольку они не образуют анионных хлоридных комплексов, тогда как большинство металлов сорбируется, проявляя значительные различия в величинах констант обмена.
Ионообменники применяют для сорбции микроэлементов и для поглощения матричных элементов. Их применение нередко затрудняется необходимостью иметь дело с большими объемами растворов. Однако при работе с микроколонками они достаточно широко используются во многих лабораториях для извлечения микроэлементов.
Комплексообразующие сорбенты.
СЛАЙД 17
К ним относятся сшитые полимеры трехмерной структуры, обладающие комплексообразующими или одновременно ионообменными и комплексообразующими свойствами, обусловленными наличием функционально-аналитических групп, входящих в состав полимера. Закрепление тем или иным способом на полимерной матрице группы атомов или молекул органических реагентов, свойства которых хорошо известны, позволило получить сорбенты, обладающие повышенной селективностью.
В качестве полимерных матриц для синтеза сорбентов используют различные соединения: полимеры линейного и пространственного строения, полученные поликонденсацией и полимеризацией, природные органические полимеры, например целлюлоза и синтетические волокна.
Селективность хелатообразующих сорбентов определяется преимущественно природой хелатообразующих групп, в них содержащихся. Кроме того, селективность сорбции зависит от условий сорбции: рН раствора, концентрации и состояния соединений в растворе, присутствия комплексообразующих веществ и солевого фона. Их используют главным образом для избирательного концентрирования и разделения элементов на стадиях анализа, предшествующих собственно определению элементов различными методами. Применяются хелатообразующие сорбенты и для тонкой очистки растворов, например кислот, щелочей и солей различных металлов.
Подбором сорбента с определенной хелатообразующей группой и условий сорбции можно достичь необходимой величины коэффициента распределения. В качестве матрицы используют не только синтетические полимеры, но и природные, особенно целлюлозу.
Хелатообразующие органические реагенты вообще не обязательно закреплять на сорбентах химическим путем; их можно закрепить на поверхности ионообменника в виде второго слоя противоионов или механически спрессовать комплексообразующий реагент с инертной матрицей. Известно множество способов приготовления сорбентов, модифицированных комплексообразующими реагентами.
Сравнительно недавно стали применять закомплексованные формы хелатообразующих сорбентов для разделения лигандов. Вследствие стерических препятствий внутренняя координационная сфера иона металла при взаимодействии с хелатообразующими группами сорбента не заполняется полностью донорными атомами этих групп. Свободные координационные места иона металла могут заполняться молекулами растворителя или другими, находящимися в растворе лигандами, которые могут легко обмениваться на различные лиганды.
Селективность лигандного обмена ярко проявляется в распознавании оптически активных лигаидов, например оптических изомеров аминокислот. Так, оптически активный сорбент с привитым L-пролином, обработанный раствором сульфата меди, в результате чего образуется полимер проявляющий высокое сродство к D-изомерам аминокислот, тогда как L-изомеры легко смываются водой.
Хелатообразующие сорбенты на основе полистирола линейного строения
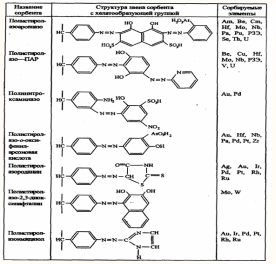
*РЗЭ – редкоземельные элементы (лантан, скандий, иттрий и др)
Кремнеземы
Кремнезем — это диоксид кремния во всех его формах: кристаллический, аморфный или гидратированный. Наиболее универсальны аморфные пористые кремнеземы, так как их структурные характеристики (величина поверхности, диаметр и объем пор, размер частиц и их прочность) можно изменять в широком интервале. Аморфный кремнезем имеет следующие разновидности: аэросилы — безводные, аморфные частицы кремнезема, получаемые при высокой температуре; аэросилогели (силохромы) — очень чистая и геометрически однородная форма пористого аморфного кремнезема с удельной поверхностью 70—150 м2/г; силикагели — сухие гели поликремниевой кислоты (одна из самых важных разновидностей аморфного кремнезема, выпускаемая промышленностью); пористые стекла — особая форма аморфного кремнезема.
Механизм ионного обмена на кремнеземах» т. е. замещение протонов поверхностных ≥Si-OH-групп на катионы, доказан достаточно надежно. Однако сродство ионов металлов к поверхности кремнезема может определяться наряду с электростатическими силами также и некоторым дополнительным донорно-акцепторным взаимодействием. Рассматривая с этих позиций причины различной сорбируемости ионов на поверхности кремнеземов, следовало ожидать, что при прочих равных условиях наибольшее сродство будут проявлять ионы, у которых связь Меn+…O-Si≤ в поверхностных группах имеет частично ковалентный характер. Следует отметить, что катионозамещенные формы кремнеземов, полученные обработкой растворами соответствующих гидроксидов, применяют достаточно часто, поскольку они обнаруживают высокую сорбционную емкость и избирательность по сравнению с кремнеземами в Н-форме.
На кремнеземах разделяют близкие по химическим свойствам элементы, например цирконий и гафний. Вследствие большого радиуса и меньшего ионного потенциала гафния его комплексообразующая способность выражена слабее. Это способствует тому, что гафний из 10 М НС1 сорбируется в виде нейтральных комплексов, тогда как цирконий находится в основном в виде анионных комплексов и его сорбция протекает в значительно меньшей степени.
Кремнеземы используют для поглощения органических примесей из воздуха; они довольно активно сорбируют полярные молекулы из водных растворов. Кремнеземы с химически привитыми молекулами органических соединений (ХМК) широко применяют в аналитической химии, биохимии.
Укажем некоторые достоинства ХМК: высокая скорость установления сорбционного равновесия (что объясняется жесткостью каркаса и малой толщиной привитого слоя), механическая прочность и ненабухаемость частиц (это позволяет значительно уменьшить время отбора пробы); легкость и полнота десорбции сорбированных компонентов небольшими объемами растворителей.
Наиболее подробно изучены и широко используются на практике кремнеземы с привитыми алкильными группами. Наиболее применимы кремнеземы с длинными алкильными цепями, обычно С8 и С18. В последнее время растет популярность кремнеземов с привитыми более короткими алкильными группами С4 и С3, особенно на широкопористых кремнеземах, используемых для анализа биологически важных высокомолекулярных соединений. Кремнеземы с привитыми арильными группами применяют реже, хотя они часто обладают более высокой селективностью, чем кремнеземы с алкильными группами.
Механизм сорбции на кремнеземах с привитыми алкильными группами сложен, в основном известны три вида взаимодействия: адсорбция сорбирующихся молекул на внешней поверхности привитого слоя, абсорбция молекул привитым слоем и взаимодействием сорбированных молекул с остаточными силанольными группами поверхности.
Взаимодействие ионов с поверхностью ХМК, содержащих ионогенные и комплексообразующие группы, осуществляется главным образом по механизму ионного обмена и комплексообразования.
