
- •Н.Ф. Клещев., н.В. Решетняк, н.М. Мартынюк Биоорганическая химия. Практикум
- •Центрифуги
- •1. Общая характеристика органических соединений.
- •Валентные состояния атома углерода
- •Концепция электронных смещений
- •Получение цис - и транс - бутен-2-овой кислот
- •2. Химические свойства органических соединений
- •Зависимость кислотности от гетероатома.
- •Влияние углеводородного радикала и присутствующих в нем заместителей
- •Влияние растворителя.
- •Основные свойства органических соединений. Π-основания и n-основания.
- •Теория Льюиса.
- •Механизм радикального замещения в общем виде
- •Определение степени окисления атомов в органических веществах
- •Окисление и восстановление органических веществ
- •3. Биологически важные органические соединения
- •3.1 Полифункциональные соединения в процессах жизенедеятельности
- •3.1.1 Общая характеристика.
- •3.1.2. Реакционная способность и специфические реакции многоатомных спиртов и фенолов
- •3.1.3 Реакционная способность и специфические реакции дикарбоновых кислот
- •3.1.5. Функциональные производные угольной кислоты
- •3.2.1 Общая характеристика
- •3.3. Реакционная способность и специфические свойства биологически важныхгетерофункциональных соединений
- •3.3.1. Аминоспирты
- •3.3.3. Гидрокси- и аминокислоты
- •3.3.4. Оксокислоты
- •3.4. Гетерофункциональные производные бензола как лекарственные средства
- •3.4 Важнейшие гетероциклические биоорганические соединения.
- •3.4.1. Общая характеристика
- •3.4.2. Номенклатура
- •3.4.3. Реакционная способность ароматических гетероциклов
- •3.4.4. Кислотно-основные и нуклеофильные свойства
- •3.4.5 Особенности реакций электрофильного замещения
- •3.4.6. Пятичленные гетероциклы
- •3.4.7 Шестичленные гетероциклы
- •3.4.8. Гетероциклы с двумя гетероатомами
- •3.4.9 Конденсированные гетероциклы
- •4. Биополимеры и их структурные компоненты
- •4.1 Углеводы. Поли-, олиго- и моносахариды.
- •4.1.1. Моносахариды
- •Цикло-оксо-таутомерия
- •Конформации
- •Неклассические моносахариды
- •Химические свойства
- •4.1.2. Олигосахариды
- •4.1.3 Полисахариды
- •4.1.3. Гетерополисахариды
- •4.2 Простые и сложные липиды.
- •4.2.1 Структурные компоненты липидов
- •4.2.2 Простые липиды
- •4.2.3 Свойства липидов и их структурных компонентов
- •4.3 Протеины, пептиды и аминокислоты.
- •4.4 Нуклеиновые и кислоты и нуклеотиды
- •4.4.1. Нуклеотиды
- •4.4.2. Структура нуклеиновых кислот
- •4.4.3. Нуклеотидные коферменты
- •Получение фосфатидилхолинов из яичного желтка
- •Эмульгирование
- •Осаждение фосфатидилхолинов хлористым кадмием
- •Гидролиз фосфатидилхолинов
- •Определение жирных кислот
- •Обнаружение глицерина
- •Обнаружение фосфора
- •Диализ белка
- •Обессоливание белкового раствора методом гель-фильтрации
- •Выделение нуклеопротеинов из дрожжей
- •Опыт №2 Гидролиз нуклеопротеинов. При выполнении данной работы следует соблюдать особую осторожность!
- •5. Физико-химические методы анализа в биоорганической химии
- •5.1 Хроматографические методы анализа
- •5.2 Спектральные методы анализа
- •5.2.1 Основные характеристики электромагнитного излучения
- •5.2.2 Молекулярная спектроскопия
- •5.2.3 Электронная спектроскопия
- •5.2.5 Масс-спектрометрия
- •5.3. Электроанализ в биоорганической химии
- •1. Экстракция липидов из биологического материала.
- •2. Фракционирование липидов методом адсорбционной хроматографии.
Теория Льюиса.
Дж. Льюисом (1923) была предложена более общая теория кислот и оснований, опирающаяся на строение внешних электронных оболочек атомов. По теории Льюиса кислотные и основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием связи.
Кислотами Льюиса могут быть атом, молекула или катион, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи.Примерами аогут служить галогениды элементов второй и третьей групп ПСЭ (BF3,AlCl3,FeCl3,ZnCl2, катионы металлов, Н+. кислоты Льюиса в гетеролитических реакциях участвуют как электрофильные реагенты.
Основаниями Льюиса могут быть атом, молекула или анион, имеющие пару валентных электронов, которые они должны предоставить партнеру для образования ковалентной связи. Основания Льюиса представляют собой нуклеофильные реагенты. К ним относятся амины, спирты, простые эфиры, тиолы, тиоэфиры, соединения, содержащие π-связи или систему сопряженных π-связей.
Важным следствием теории Льюиса является то, что любое органическое соединение можно представить как кислотно-основной комплекс. Например, этилиодид можно рассматривать как комплекс, состоящий из этил-катиона С2Н5+(кислота Льюиса) и иодид иона –I (основание Льюиса). Отсюда большинство реакций с этилиодидом можно классифицировать как обмен иодид-иона на другие основания Льюиса (ОН-, СN-,NH2-,H3C-O-) или как обмен этил-катиона на другие кислоты Льюиса (К+, Н+и др.).
2.2 Радикальные и электрофильные реакции углеводородов и их производные
Реакции радикального замещения (SR)
Реакции SR наиболее характерны для соединений алифатического и ациклического рядов. Как правило, они протекают по цепному механизму, основными стадиями которого являются: инициирование, развитие (рост цепи) и обрыв цепи.
На стадии инициирования образуются свободные радикалы, дающие начало цепному процессу.
Свободные радикалы могут возникать за счет термического или фотохимического инициирования, а также в результате ОВ реакций.
Стадия развития цепи протекает при низкой энергии активации.
Обрыв цепи возникает в случае рекомбинации свободных радикалов.
Механизм радикального замещения в общем виде

В реакцияхSRатака радикала направлена на электронную пару С―Н, в которой углерод имеет наибольшую электроотрицательность.
Легкость отрыва атома Н от углерод-атома падает в ряду углеводородов.

Интересны реакции бромирования, т.к. радикалы брома (Вr˙)обладают высокой избирательностью: если в молекуле имеются вторичный, а тем более третичный атом углерода, то бромирование преимущественно идет у третичного (вторичного) атома углерода. Такие реакции называются региоселективными (избирательными по месту действия) реакциями.

Реакции электрофильного присоединения
Электрофильное присоединение (АЕ) характерно для ненасыщенных систем, содержащих двойные или тройные связи. Нуклеофильный характер таких соединений обусловлен наличием π-связи, которая представляет собой область с повышенной электронной плотностью, обладает поляризуемостью и легко разрывается под действием электрофильных реагентов.
Механизм реакций АЕвключает две стадии.

По такому механизму происходят следующие реакции.
1. Галогенирование.
Галогенирование (бромирование) этилена несколько отличается и механизм этой реакции можно представить следующим образом

Бромирование непредельных углеводородов (алкенов, алкинов, алкадиенов) является качественной реакцией (обесцвечивание бромной воды).
2. Гидрирование

3. Гидрогалогенирование

4. Гидратация

Нуклеофильная атака карбкатиона (σ-комплекс) происходит со стороны, противоположной к имеющемуся заместителю, что связано со стерическими препятствиями.
При присоединении соединений типа НХ (галогеноводороды, серная кислота, Н2О) соблюдается правило Марковникова.
При взаимодействии реагентов НХ с несимметричными алкенами, водород присоединяется к наиболее гидрогенизировагнному атому углерода.
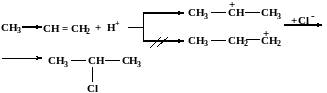
Это можно объяснить более высокой устойчивостью вторичного (изопропилий) катиона, по сравнению с первичным (пропилий).
Классическое правило Марковникова идеально применимо только к самим алкенам, в случае их производных необходимо учитывать и механизм реакции и устойчивость образующихся интермедиатов.
Рассмотрим гидратацию ненасыщенных карбоновых кислот. Так, например, при гидратации ненасыщенных кислот в кислой среде образуются β-гидроксикарбоновые кислоты. Такого типа гидратация invivo является частью процесса β-окисления ненасыщенных жирных кислот в организме.

Реакции АЕ в ряду алкадиенов
Рассмотрим наиболее термодинамически устойчивые, а потому наиболее часто встречаемые в природе сопряженные системы.
Реакции АЕ с такими диенами протекают с образованием двух продуктов 1,4- и 1,2-присоединения.
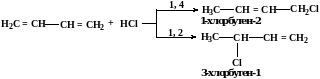
Соотношение между продуктами 1,4- и 1,2-присоединения зависит от условий проведения реакции, но, как правило, продукта 1,4-присоединения в смеси больше, чем продукта 1,2-присоединения.
Такая особенность в реакциях АЕ с диенами связана с образованием двух интермедиатов (карбкатионов), имеющих мезомерное строение.

Аналогично, как и для алкенов, протекают реакции гидратации для алкинов (Реакция Кучерова).

Альдегид в реакции Кучерова образуется только с ацетиленом, в случае производных ацетилена в реакции гидратации образуются соответствующие кетоны.
2.3 Нуклеофильные реакции
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Нуклеофильные ("любящие ядро") реагенты, или нуклеофилы - это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне.
Примеры нуклеофильных частиц:H2O, CH3OH, NH3, CN, Br, Cl, OH–
Строение некоторых нуклеофильных реагентов

Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:CH2=CH2, CH2=CH–CH=CH2, C6H6 ит.п.
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Нуклеофильное замещение:

Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов:S – substitution [замещение], N – nucleophile [нуклеофил]).
Нуклеофильное присоединение:
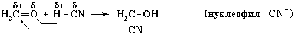
Обозначение механизма - AdN (Ad – addition [присоединение]).
Моно- и бимолекулярное нуклеофильное замещение и отщепление
Нуклеофильное замещение при насыщенном атоме углерода — это тот тип органических реакций, механизмы которого изучались наиболее подробно.
Основополагающий вклад в изучение реакций замещения у sp3-гибридизованного атома углерода внес Ингольд. Классическим примером реакции нуклеофильного замещения является превращение алкилгалогенида в спирт:
R-Cl + OН–→ R–OH + Cl–
Обозначение реакций (SN1) и (SN2) было предложено Ингольдом и расшифровывается, соответственно, как нуклеофильное замещение мономолекулярное и бимолекулярное (от англ. Substitution nucleophilic).
Мономолекулярное нуклеофильное замещение (SN1)
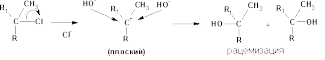
Бимолекулярное нуклеофильное замещение (SN2)
Предполагается,
что реакция протекает по следующей
схеме:

Если в исходном соединении существовала какая-нибудь оптическая конфигурация (D-, L- ), то в результате реакции происходит ее обращение (L-, D-).
В реакции этого типа преимущественно вступают пространственно незатрудненные первичныеалкилгалогениды, при отщеплении уходящей группы от которых не образуется стабилизированного карбкатиона.
Влияние различных факторов на реакции нуклеофильного замещения у насыщенного атома углерода
Факторы |
(SN1) |
(SN2) |
Строение субстрата |
Реакционная способность падает в ряду: Бензильный, аллильный > третичный > вторичный > первичный |
Реакционная способность растет в ряду: Бензильный, аллильный < третичный < вторичный < первичный |
Вступающая группа |
Практически нет влияния |
Чем больше нуклеофильность, тем вероятнее протекание реакции |
Уходящая группа |
Чем ниже энергия связи, тем легче протекает реакция |
Замещение затрудняется с увеличением нуклеофильности (основности) уходящей группы |
Стерические факторы |
Увеличение числа алкильных заместителей и электронодонорных групп у нуклеофильного центра способствует протеканию реакции. |
Препятствуют атаке нуклеофильного центра и затрудняют реакцию |
Влияние растворителя |
Реакции способствуют протонные полярные растворители |
Влияние растворителя сказывается значительно меньше, но реакцию затрудняют растворители, сольватирующие нуклеофил. В целом, лучше протекают с апротонными полярными растворителя. |
Концентрация нуклеофила |
На скорость реакции не влияет |
Скорость реакции пропорциональна концентрации нуклеофила |
2.4 Окисление и восстановление органических веществ
Все химические реакции можно разделить на два типа. К первому относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ.
Ко второму типу относятся все реакции, идущие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
С современной точки зрения изменение степени окисления связано с оттягиванием или перемещением электронов. Поэтому наряду с приведенным можно дать и такое определение восстановительно-окислительных реакций: это такие реакции, при которых происходит переход электронов от одних атомов, молекул или ионов к другим.
Рассмотрим основные положения, относящиеся к теории окислительно-восстановительных реакций.
1. Окислением называется процесс отдачи электроном атомом, молекулой или ионом электронов, степени окисления при этом повышаются.
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом, степень окисления при этом понижается.
3. Атомы, молекулы или ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями. Во время реакции они восстанавливаются.
4. Окисление всегда сопровождается восстановлением; восстановление всегда связано с окислением, что можно выразить уравнениями.
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов – окисления и восстановления. В этих реакциях число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем. При этом независимо от того, переходят ли электроны с одного атома на другой полностью или лишь частично оттягиваются к одному из атомов, условно говорят только об отдаче и присоединения электронов.
Окислительно-восстановительные реакции органических веществ – важнейшее свойство, объединяющее эти вещества. Склонность органических соединений к окислению связывают с наличием кратных связей, функциональных групп, атомов водорода при атоме углерода, содержащем функциональную группу.
Применение понятия «степени окисления» (СО) в органической химии очень ограничено и реализуется, прежде всего, при составлении уравнений окислительно-восстановительных реакций. Однако, учитывая, что более или менее постоянной состав продуктов реакции возможен только при полном окислении (горении) органических веществ, целесообразность расстановки коэффициентов в реакциях неполного окисления отпадает. По этой причине обычно ограничиваются составлением схемы превращений органических соединений.
