
- •Н.Ф. Клещев., н.В. Решетняк, н.М. Мартынюк Биоорганическая химия. Практикум
- •Центрифуги
- •1. Общая характеристика органических соединений.
- •Валентные состояния атома углерода
- •Концепция электронных смещений
- •Получение цис - и транс - бутен-2-овой кислот
- •2. Химические свойства органических соединений
- •Зависимость кислотности от гетероатома.
- •Влияние углеводородного радикала и присутствующих в нем заместителей
- •Влияние растворителя.
- •Основные свойства органических соединений. Π-основания и n-основания.
- •Теория Льюиса.
- •Механизм радикального замещения в общем виде
- •Определение степени окисления атомов в органических веществах
- •Окисление и восстановление органических веществ
- •3. Биологически важные органические соединения
- •3.1 Полифункциональные соединения в процессах жизенедеятельности
- •3.1.1 Общая характеристика.
- •3.1.2. Реакционная способность и специфические реакции многоатомных спиртов и фенолов
- •3.1.3 Реакционная способность и специфические реакции дикарбоновых кислот
- •3.1.5. Функциональные производные угольной кислоты
- •3.2.1 Общая характеристика
- •3.3. Реакционная способность и специфические свойства биологически важныхгетерофункциональных соединений
- •3.3.1. Аминоспирты
- •3.3.3. Гидрокси- и аминокислоты
- •3.3.4. Оксокислоты
- •3.4. Гетерофункциональные производные бензола как лекарственные средства
- •3.4 Важнейшие гетероциклические биоорганические соединения.
- •3.4.1. Общая характеристика
- •3.4.2. Номенклатура
- •3.4.3. Реакционная способность ароматических гетероциклов
- •3.4.4. Кислотно-основные и нуклеофильные свойства
- •3.4.5 Особенности реакций электрофильного замещения
- •3.4.6. Пятичленные гетероциклы
- •3.4.7 Шестичленные гетероциклы
- •3.4.8. Гетероциклы с двумя гетероатомами
- •3.4.9 Конденсированные гетероциклы
- •4. Биополимеры и их структурные компоненты
- •4.1 Углеводы. Поли-, олиго- и моносахариды.
- •4.1.1. Моносахариды
- •Цикло-оксо-таутомерия
- •Конформации
- •Неклассические моносахариды
- •Химические свойства
- •4.1.2. Олигосахариды
- •4.1.3 Полисахариды
- •4.1.3. Гетерополисахариды
- •4.2 Простые и сложные липиды.
- •4.2.1 Структурные компоненты липидов
- •4.2.2 Простые липиды
- •4.2.3 Свойства липидов и их структурных компонентов
- •4.3 Протеины, пептиды и аминокислоты.
- •4.4 Нуклеиновые и кислоты и нуклеотиды
- •4.4.1. Нуклеотиды
- •4.4.2. Структура нуклеиновых кислот
- •4.4.3. Нуклеотидные коферменты
- •Получение фосфатидилхолинов из яичного желтка
- •Эмульгирование
- •Осаждение фосфатидилхолинов хлористым кадмием
- •Гидролиз фосфатидилхолинов
- •Определение жирных кислот
- •Обнаружение глицерина
- •Обнаружение фосфора
- •Диализ белка
- •Обессоливание белкового раствора методом гель-фильтрации
- •Выделение нуклеопротеинов из дрожжей
- •Опыт №2 Гидролиз нуклеопротеинов. При выполнении данной работы следует соблюдать особую осторожность!
- •5. Физико-химические методы анализа в биоорганической химии
- •5.1 Хроматографические методы анализа
- •5.2 Спектральные методы анализа
- •5.2.1 Основные характеристики электромагнитного излучения
- •5.2.2 Молекулярная спектроскопия
- •5.2.3 Электронная спектроскопия
- •5.2.5 Масс-спектрометрия
- •5.3. Электроанализ в биоорганической химии
- •1. Экстракция липидов из биологического материала.
- •2. Фракционирование липидов методом адсорбционной хроматографии.
Валентные состояния атома углерода
Валентное состояние |
Взаимодействующие орбитали |
Пространственная структура |
Тип связи |
Вал.угол |
sp3 |
|
тетраэдричная |
4 σ |
109°28' |
sp2 |
|
плоская |
3 σ, 1 π |
120° |
sp |
|
линейная |
2 σ, 2 π |
180° |
С изменением типа гибридизации углеродного атома меняются и его свойства. При переходе от sp3 кsp возрастает доляs- орбитали в составе гибридизованного облака, что влечет за собой изменение его формы. Границы электронного облака приближаются к ядру в случаеsp2иsp- орбиталей, по сравнению сsp3- облаком. Это отражается на увеличении электроотрицательности атома углерода в ряду:sp3<sp2<sp. В связи с этим, уменьшается ковалентный радиус, увеличивается полярность связи.
Виды химической связи
Ионная связь
-возникает в случае полной отдачи электронов одними атомами и приобретением их другими. При этом атомы превращаются в ионы.
Ковалентная связь
- образуется путем обобществления электронов. Связывание атомов в молекуле осуществляется электронной парой, принадлежащей одновременно двум атомам. Обобществление электронов возможно двумя способами:
1) коллигация (обменный механизм);
2) координация (донорно-акцепторный механизм).
Существует два типа ковалентной связи: σ (сигма)- и π (пи)- связи.
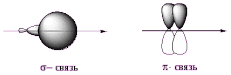
σ-связью называется одинарная ковалентная связь, образованная при перекрывании атомных орбиталей по прямой (оси), соединяющей ядра двух связанных атомов с максимумом перекрывания на этой прямой.
π-связью называется связь, образованная при боковом перекрывании негибридизованных pz-атомных орбиталей с максимумом перекрывания по обе стороны от прямой, соединяющих ядра атомов.
Количественные характеристики ковалентной связи
1. Энергия связи – это энергия, выделяющаяся при образовании связи или необходимая для её разрыва.
2. Длина связи – это расстояние между центрами связанных атомов.
3. Полярность связи – неравномерность распределения электронной плотности.
4. Поляризуемость связи – смещение электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы.
Межмолекулярные взаимодействия

Концепция электронных смещений
В ходе химических реакций происходит перераспределение валентных электронов, поэтому направление, легкость и механизмы реакций существенно зависят от электронного строения участвующих в них молекул.
В молекулах проявляется влияние не только соседних атомов, но и атомов, не связанных друг с другом.
Резкое увеличение кислотных свойств – обусловлено смещением электронной плотности в молекуле под влиянием этого электроотрицательного атома.
Взаимное влияние атомов в молекулах может реализовываться двумя путями:
I. Индуктивный эффект– способность заместителя поляризоватьσ-связь (I).

Характерные черты индуктивного эффекта
1. Индуктивный эффект передаётся по цепи атомов в одном направлении:

Знак индуктивного эффекта определяется по частичному заряду, приобретаемому заместителем, вызывающим этот эффект:
- I: (СН3)3N+ > NO2 > F > Cl > Br > I > OH > NH2
+I: CH3< C2H5<CH(CH3)2< C(CH3)3< Me (Li, Na, K)
2. Сила индуктивного эффекта зависит от природы заместителя. Для электроотрицательных заместителей Iвозрастает с ростом ЭО атома и увеличением их числа в молекуле. Алкильные радикалы вызывают слабый (+I), причем он тем больше, чем длиннее и разветвленнее радикал.
3. Индуктивный эффект быстро затухает по цепи.
4. Индуктивные эффекты – аддитивны (могут суммироваться).
II. Мезомерный эффект (эффект сопряжения)– влияние заместителя, обладающего р- или π- электронами, в результате которого происходит перераспределение π-электронной плотности связи (М).
Графически мезомерный эффект представляют в виде граничных структур и мезоформ:

Направление мезомерного эффекта определяется по знаку дробного заряда, проявляющегося на заместителе, ответственном за данный эффект:
-М: =O, =S, -NO2, -C≡N, =NR
+М: :NR2, :OR, :SR, :Hal
Мезомерный эффект особенно важен для систем, в которых две π-электронные или другие имеющие р-орбитали группы соединены друг с другом одной σ-связью. В этом случае при планарном расположенииpz-орбиталей обе группы взаимодействуют между собой – сопрягаются. Подобные системы, характеризующиеся широкой делокализацией π-электронов и обладающие более низкой энергией относят к сопряженным.
Виды мезомерного эффекта (сопряжения):
π,π-сопряжение
1. Сопряжение полярной и неполярной ненасыщенных групп:

2. Сопряжение неполярных ненасыщенных групп:


р,π-сопряжение
1. Сопряжение группы, имеющей НЭП и неполярной ненасыщенной группы:

2. Сопряжение карбокатионного или карбоанионного центра и кратной связи:

3. Сопряжение радикального центра и кратной связи:

σ,π-сопряжение
- взаимодействие π-электронов кратной связи и σ-электронов связи С-Н, отделенных друг от друга одной σ-связью (гиперконьюгация).
При одновременном проявлении индуктивного и мезомерного эффектов, последний (М) по абсолютной величине, как правило, больше и является решающим:
Вопросы для проверки полученных знаний.
1. Основные понятия и классификация органических соединений.
2. Основные функциональные группы органических соединений.
3.Опишите понятие гомологический ряд. Приведите примеры.
4. Особенности строения атома углерода.
5. Изомеризация, виды изомеризации.
6. Сравнительная характеристика органических и неорганических соединений и реакций с их участием
7. Теории строения органических веществ. Основные положения .
8. Структурная изомерия.
9. Изомерия положения.
10 Свойства структурных изомеров,
11. Таутомерия.
12. Геометрическая изомерия.
13. Конформационная изомерия.
14. Конфигурационная изомерияю
15. Оптическая изомерия.
16. Химическая связь в органических соединениях.
17. Валентные состояния атома углерода.
18. Ионная связь.
19. Ковалентная связь. Количественные характеристики ковалентной связи.
20. Межмолекулярные взаимодействия.
21. Концепция электронных смещений.
22. Индуктивный эффект.
23. Мезомерный эффект (эффект сопряжения). Виды мезомерного эффекта (сопряжения)
ЛАБОРАТОРНАЯ РАБОТА №1. ОПРЕДЕЛЕНИЕ КЛАССОВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Принадлежность органических веществ к определенным классам соединений и их строение можно установить с помощью элементного и функционального анализа.
Качественный элементный анализ позволяет определить, из каких элементов построены молекулы вещества, и установить его простейшую формулу. Наиболее часто в состав органических веществ, помимо углерода и водорода, входят кислород, сера, азот и галогены.
При выполнении элементного анализа органическое соединение разлагают таким образом, чтобы исследуемые элементы перешли в состав неорганических веществ. При этом углерод переходит в оксид углерода (IV), водород — в воду, азот — в цианид-ион, аммиак или молекулярный азот, сера — в сульфид. Дальнейшее определение элемента проводят обычными методами аналитической химии.
Опыт 1. Обнаружение углерода пробой на обугливание
Реактивы и оборудование:сахар (или мука, крахмал), бумага, 1%-ный раствор серной кислоты, концентрированная серная кислота; фарфоровые чашки, шпатели, держатели, цилиндры на 50 мл, стеклянные палочки.
Первой пробой на обнаружение углерода в неизвестном органическом веществе является его прокаливание или обугливание под действием водоотнимающих веществ, например концентрированной серной кислоты.
В фарфоровую чашку (тигель) насыпают немного муки, крахмала или сахара (0,1—1,2 г), закрепляют ее в держателе. Осторожно нагревают чашку в пламени горелки и прокаливают исследуемое вещество до обугливания (почернения).
На листочке фильтровальной бумаги (целлюлозе) при помощи стеклянной палочки делают надпись 1%-ным раствором серной кислоты. После высыхания такая надпись будет невидна. После нагревания бумаги над пламенем газовой горелки или над электрической плиткой надпись, сделанная серной кислотой, проявляется в виде черных обугленных полос.
В фарфоровой ступке растирают 25 г быстрорастворимого сахара и добавляют 3 мл воды. Образовавшуюся смесь переносят в стеклянный цилиндр вместимостью 50 мл и постепенно, непрерывно перемешивая стеклянной палочкой, добавляют 12,5 мл концентрированной серной кислоты. С началом обугливания стеклянную палочку приподнимают. Смесь вспучивается, и черная пористая масса поднимается по палочке (демонстрационный опыт).
Опыт 2.Обнаружение углерода и водорода окислением вещества оксидом меди (II)
Реактивы и оборудование: сахар (предварительно просушенный), оксид меди (II) — порошок, известковая (или баритовая) вода — насыщенный раствор гидроксида кальция или бария, безводный сульфат меди (II) — свежепрокаленный; изогнутые газоотводные трубки с пробками для пробирок, вата.
В сухую пробирку насыпают порошок оксида меди (II) (около 1 г) и 0,1—0,2 г сахарозы. Избыток оксида меди необходим для того, чтобы органическое вещество полностью было окислено. Смесь перемешивают и сверху добавляют дополнительно около 0,5—1 г оксида меди.
В верхнюю часть пробирки помещают маленький комочек ваты, на который насыпают немного обезвоженного сульфата меди (II). Пробирку закрывают пробкой с газоотводной трубкой (рис. 1).
Пробирку закрепляют в лапке штатива с небольшим наклоном в сторону пробки. Свободный конец газоотводной трубки опускают в пробирку с известковой (баритовой) водой. Сначала прогревают всю пробирку, а потом сильно нагревают часть пробирки с реакционной смесью.
Окисление углевода можно представить следующим уравнением:
C12H22O11 + 24СuО → 12CO2 + 11H2O + 24СuО
Выделяющиеся в процессе прокаливания пузырьки газа (СО2) вызывают помутнение известковой воды вследствие образования белого осадка СаСО3:
СO2+ Са(ОН)2↔ СаСO3 + Н2О

Рисунок 1 - Прибор для одновременн1 — сухая пробирка со смесью сахарозы и оксида меди (II);2 — вата;3 — безводный сульфат меди;4 — пробирка известковой водой
Выделяющаяся в процессе реакции вода окрашивает сульфат меди (II) в синий цвет в результате образования кристаллогидрата CuSO4 • 5Н2О.
Опыт 3. Обнаружение азота сплавлением вещества с металлическим натрием.
Реактивы и оборудование:мочевина, металлический натрий, 5%-ный раствор сульфата железа (II), 1-%-ный раствор хлорида железа (III), 10%-ная соляная кислота, этиловый спирт, лакмусовая бумага; пинцеты, скальпели, фильтровальная бумага, пипетки.
Метод основан на том, что при сплавлении органического вещества, содержащего азот, с металлическим натрием происходит разложение вещества с образованием цианида натрия. Для обнаружения цианида натрия используют реакцию получения берлинской лазури. Свое название цианид натрия получил от латинского названия cyanus — синий, т.е. способный давать синюю окраску.
В сухую пробирку вносят несколько кристаллов мочевины H2N—СО—NH2и небольшой кусочек металлического натрия (с небольшую горошину), предварительно очищенного от корки и не содержащего остатков керосина. Вместо мочевины можно взять другое органическое вещество, содержащее азот, например анилин, ацетамид, яичный белок и др.
Смесь осторожно нагревают в пламени горелки (тяга, защитные очки). Разложение вещества сопровождается вспышкой. После вспышки пробирку нагревают до красного каления еще 1—2 мин. Необходимо отметить, что натрий должен плавиться вместе с мочевиной, иначе не будет образовываться цианид натрия, и опыт окажется неудачным. После охлаждения пробирки на воздухе в нее добавляют 3—5 капель этилового спирта для удаления остатков металлического натрия:
2С2Н5ОН + 2Na → 2C2H5ONa + Н20
Затем в пробирку приливают 1,5 мл дистиллированной воды и нагревают ее до полного растворения плава при помешивании стеклянной палочкой. На этом этапе цианид натрия переходит в раствор, который затем переливают в другую пробирку (при необходимости его фильтруют через маленький складчатый фильтр). Если органическое вещество разложилось частично, то жидкость будет окрашена в бурый или черный цвет. В этом случае плавление исследуемого вещества с металлическим натрием необходимо повторить.
К фильтрату добавляют 2—3 капли 5%-ного раствора сульфата железа (II) и 1 каплю 1%-ного раствора хлорида железа (III) и наблюдают выпадение осадков гидроксида железа (II) грязно-зеленого цвета и гидроксида железа (III) бурого цвета в щелочной среде:
FeSO4+ 2NaOH ↔ Fe(OH)2 + Na2SO4
FeCl3+ 3NaOH ↔ Fe(OH)3 + 3NaCl
В случае избытка цианида натрия в растворе будет образовываться гексацианоферрат (II) натрия:
Fe(OH)2+ 2NaCN →Fe(CN)2+ 2NaOH
Fe(CN)2+ 4NaCN → Na4[Fe(CN)6]
После перемешивания содержимого пробирки его подкисляют 10% -ной соляной кислотой (несколько капель). Смесь осадков гидроксидов железа (II) и (III) растворяется, и появляется синяя окраска (берлинская лазурь), а затем выпадает синий осадок. Берлинская лазурь образуется при взаимодействии гексацианоферрата (II) натрия с ионами трехвалентного железа, которые появляются только в кислой среде. В щелочной среде обычно содержится недиссоциированный гидроксид железа (III):
Fe(OH)3+ 3НС1 → FеС13+ 3Н2О
4FeCl3+ 3Na4[Fe(CN)6] → Fe4[Fe(CN)6]3+ 12NaCl
Если берлинской лазури образуется очень мало, то раствор окрашивается в зеленый цвет, переходящий в синий при длительном стоянии.
Опыт 4. Определение серы сплавлением органического вещества с металлическим натрием.
Реактивы и оборудование: тиомочевина, металлический натрий, 2% раствор ацетата свинца, 2% расвор нитропруссида натрия (всежеприготовленый), 10%-ная соляная кислота, уксусная кислота, этиловый спирт; скальпели, пинцеты, пипетки, стеклянные палочки, фильтровальная бумага.
Принцип метода состоит в том, что при сплавлении металлического натрия с изучаемым органическим веществом происходит его разложение, и выделяющаяся сера образует с натрием соответствующий сульфид. Далее сульфид-ион S2-обнаруживают обычными качественными реакциями.
В сухую пробирку помещают несколько крупинок тиомочевины (или сульфаниловой кислоты, белого стрептоцида, сухого белка и т.д.) и кусочек металлического натрия с блестящей поверхностью размером с небольшую горошину. Далее проводят сплавление (тяга, защитные очки) так, как было описано в опыте 3 (определение азота). Полученный раствор, содержащий сульфид натрия, разливают в три пробирки.
В первую пробирку добавляют несколько капель уксусной кислоты, а затем приливают 0,5 мл 2%-ного раствора ацетата свинца. Образуется черный осадок сульфида свинца. Если образуется черный или бурый коллоидный раствор, то его нагревают, и образование осадка ускоряется:
Na2S + Pb(CH3COO)2→ PbS + 2CH3COONa
Во вторую пробирку приливают 0,5 мл 2%-ного раствора нитропруссида натрия Na2[Fe(CN)5NO]. Появляется интенсивное красно-фиолетовое окрашивание раствора, которое постепенно переходит в бурое:
Na2S + Na2[Fe(CN)5NO] → Na4[Fe(CN)5NOS]
Эта реакция значительно чувствительнее реакции с ацетатом свинца.
В третью пробирку с раствором добавляют 10%-ную соляную кислоту, при этом появляется запах сероводорода:
Na2S + 2НС1 → 2NaCl + H2S
Опыт 5.Определение галогенов в органических веществах
Реактивы и оборудование:хлороформ, дистиллированная вода, соляная кислота, этиловый спирт, металлический натрий, 1%-ный раствор нитрата серебра, концентрированная азотная кислота, синяя лакмусовая бумага; медная проволока с петлей на конце, вставленная другим концом в корковую пробку, прямые газоотводные трубки, стаканы на 150 мл, пинцеты, скальпели, фильтровальная бумага.
Реакция Бейльштейна на галогены.При прокаливании галогеносодержащего органического вещества с оксидом меди (II) происходит его окисление, причем галогены (кроме фтора) образуют с медью летучие галогениды, окрашивающие пламя в ярко-зеленый цвет.
Петлю медной проволоки прокаливают в пламени горелки до прекращения окрашивания пламени и образования на поверхности черного налета оксида меди (II):
2Сu + О2 → 2СuО
Остывшую петлю смачивают хлороформом или тетрахлоридом углерода, а затем снова вносят в пламя газовой горелки. Сначала пламя становится светящимся благодаря сгоранию углерода, а потом окрашивается в ярко-зеленый цвет:
2СНС13+ 5СuО → СuС12+ 4СuС1 + 2СО2 + Н2О
Для очистки проволоку смачивают соляной кислотой и прокаливают.
Метод Степанова (определение галогенов действием металлического натрия на спиртовой раствор органического вещества).Для определения галогена в органическом веществе его восстанавливают водородом в момент выделения, при этом галоген отщепляется в виде аниона, который можно открыть качественной реакцией с нитратом серебра.
В пробирку наливают 2—3 мл этилового спирта и добавляют 1 каплю хлороформа или другого галогеносодержащего органического вещества (тетрахлорид углерода, йодоформ и др.). В полученную смесь вносят кусочек металлического натрия величиной с небольшую горошину. Начинается энергичная реакция, сопровождающаяся выделением водорода, причем часть водорода в момент выделения участвует в восстановлении хлороформа:
2С2Н5ОН + 2Na → 2C2H5ONa + 2[Н+]
СНС13+ 6[Н+] → 3НС1 + СН4
НС1 + C2H5ONa → NaCl + С2Н5ОН
Пробирку закрывают пробкой с прямой газоотводной трубкой и поджигают выделяющийся водород.
После окончания выделения водорода и полного растворения натрия к реакционной смеси добавляют 2 мл дистиллированной воды. Избыток алкоголята натрия реагирует с водой с образованием гидроксида натрия:
C2H5ONa + Н2О → С2Н5ОН + NaOH
В воде также растворяется белый осадок хлорида натрия, плохо растворимый в этиловом спирте. Необходимо отметить, что в присутствии щелочи нельзя обнаружить хлорид-ион реакцией с нитратом серебра, так как при его добавлении будет образовываться бурый осадок гидроксида серебра. Поэтому полученный щелочной раствор подкисляют несколькими каплями концентрированной азотной кислоты (контроль по лакмусовой бумаге) и к кислому раствору добавляют несколько капель 1%-ного раствора нитрата серебра. Наблюдают выпадение белого творожистого осадка хлорида серебра:
NaCl + AgNО3→ NaNO3+ AgCl
Необходимо помнить, что при выполнении опыта нельзя брать избыток хлороформа, так как хлороформ, не прореагировавший с водородом, при разбавлении реакционной смеси водой дает стойкую белую эмульсию, которая в дальнейшем будет маскировать появление белого осадка при проведении качественной реакции с нитратом серебра.
ЛАБОРАТОРНАЯ РАБОТА №2. СООТНОШЕНИЕ ЛИНЕЙНОСТИ СВОБОДНОЙ ЭНЕРГИИ В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ.
Приборы и реактивы. Кислоты: бензойная, анилиния, п-толуиловая, м-толуиловая, п-хлорбензойная, м-хлорбензойная, п-оксибензойная, п-нитробензойная; хлористоводородные соли п-толуидина, м-толуидина, п-хлоранилиния, м-хлоранилиния, п-оксианилиния, п-нитроанилиния. Стандартный 0,01 н. раствор едкого натра, рН-метр, автоматическая бюретка на 10 мл класса А, магнитная мешалка Анилинийхлориды получают пропусканием сухого газообразного НС1 в охлаждаемый льдом безводный эфирный раствор соответствующего производного анилина; выпавшие соли перекристаллизовывают из этанола и отфильтровывают.
Методика эксперимента. Возьмите навески (около 50 мг) каждой кислоты в чистые стаканы емкостью 100 мл. Растворите соли анилиния в 50 мл дистиллированной воды, а менее растворимые бензойные кислоты в таком же объеме 10%-ного водного этилового спирта (для полного растворения, если необходимо, раствор подогрейте). В каждый раствор поместите стеклянный и каломельный электроды, присоединенные к рН-метру, и, перемешивая раствор магнитной мешалкой, проведите титрование 0,01 н. раствором едкого натра. Снимите показания рН-метра в зависимости от объема добавленного титранта, пока не будет пройдена точка эквивалентности. Постройте кривую титрования, как это показано на рисунке 2; определите по ней точку эквивалентности и рН при полунейтрализации. Запишите температуру, при которой были сделаны измерения, и составьте таблицу найденных значений К в зависимости от заместителя:
К= [H3O+ ], или pK=pH.

Рисунок 2 – Общий вид кривой титрования
Обработка результатов. Вы стремились установить влияние заместителей на свободную энергию активации ∆F≠ . При диссоциации это влияние должно проявляться в изменении log K, поскольку
ΔF = RT ln K ≠
(В данном случае равновесная ∆F≠ представляет собой разность свободных энергий активации для прямой и обратной реакций, но это не сказывается на результатах.) Для того чтобы сравнить влияние заместителей, выбирают стандартный заместитель - атом водорода, электронные эффекты которого в реакции условно приняты равными нулю. Тогда бензойная кислота и анилинийхлорид являются стандартными кислотами в обеих сериях и имеют соответственно константы диссоциации K0 и К0`. Если рассмотреть замещенную бензойную кислоту (K) и соответствующую соль анилиния (К'), например п-хлорбензойную кислоту и n-хлоранилинийхлорид, то может оказаться, что влияние n-С1 на ионизацию каждой кислоты будет одинаковым по направлению, но не обязательно равным по величине, и тогда
 (1)
(1)
где ρ0 и ρ являются константами реакций и выражают относительную чувствительность двух равновесий к электронным эффектам. Для всех других заместителей ρ0 и ρ будут одинаковы.
Для удобства применения соотношения (1) можно ввести дальнейшие упрощения. Если реакцию ионизации бензойной кислоты при 25°С принять за стандартную, то ρ0 можно приравнять к единице и влияние заместителей на это равновесие окажется характеристикой только заместителя.
Следовательно,
 (2),
(2),
где σ - константа заместителя; K и σ относятся к определенному заместителю и определенному положению в кольце.
Поэтому можно записать
 (3).
(3).
Применимость этого соотношения ко многим реакциям бензольного кольца была показана Гамметом.
1. По уравнению (2) вычислите значения σ для всех рассмотренных заместителей, используя константы диссоциации бензойных кислот.
2. Для солей анилиния постройте зависимость σ от log (K'/Ko) Проведите через точки наилучшую прямую (по возможности по методу наименьших квадратов) и оцените ρ из наклона [уравнение (В)]. Интерпретация результатов. Введение электроноакцепторных групп увеличивает степень диссоциации кислот, так как протон уходит, оставив свои электроны:

Поэтому из уравнения (2) следует, что σ будет положительной (относительно водорода) для электроноакцепторных заместителей (logК > logK0) и отрицательной для электронодонорных (logК > logK0). Следовательно, можно определить величину электронного эффекта. Кроме того, если передача влияния осуществляется исключительно по индуктивному механизму (поляризация σ-связей), σ будет пример но одинаковой для мета- и пара-положений, обычно несколько больше для лета-положения, находящегося ближе к реакционному центру. Однако, если резонансные структуры дают вклад в перенос заряда, влияние будет больше (положительное или отрицательное) из пара-положения. Знак и величина ρ также являются информативными; положительное значение указывает на большую чувствительность рассматриваемой реакции к электронным эффектам по сравнению с реакцией ионизации бензойных кислот.
ЛАБОРАТОРНАЯ РАБОТА №3.
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ И ПРОТОННЫЙ РЕЗОНАНС В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ
Необходимые реактивы. Ацетоуксусный эфир, амальгама натрия (1%), пятихлористый фосфор, бензол (безводный)
