
- •Н.Ф. Клещев., н.В. Решетняк, н.М. Мартынюк Биоорганическая химия. Практикум
- •Центрифуги
- •1. Общая характеристика органических соединений.
- •Валентные состояния атома углерода
- •Концепция электронных смещений
- •Получение цис - и транс - бутен-2-овой кислот
- •2. Химические свойства органических соединений
- •Зависимость кислотности от гетероатома.
- •Влияние углеводородного радикала и присутствующих в нем заместителей
- •Влияние растворителя.
- •Основные свойства органических соединений. Π-основания и n-основания.
- •Теория Льюиса.
- •Механизм радикального замещения в общем виде
- •Определение степени окисления атомов в органических веществах
- •Окисление и восстановление органических веществ
- •3. Биологически важные органические соединения
- •3.1 Полифункциональные соединения в процессах жизенедеятельности
- •3.1.1 Общая характеристика.
- •3.1.2. Реакционная способность и специфические реакции многоатомных спиртов и фенолов
- •3.1.3 Реакционная способность и специфические реакции дикарбоновых кислот
- •3.1.5. Функциональные производные угольной кислоты
- •3.2.1 Общая характеристика
- •3.3. Реакционная способность и специфические свойства биологически важныхгетерофункциональных соединений
- •3.3.1. Аминоспирты
- •3.3.3. Гидрокси- и аминокислоты
- •3.3.4. Оксокислоты
- •3.4. Гетерофункциональные производные бензола как лекарственные средства
- •3.4 Важнейшие гетероциклические биоорганические соединения.
- •3.4.1. Общая характеристика
- •3.4.2. Номенклатура
- •3.4.3. Реакционная способность ароматических гетероциклов
- •3.4.4. Кислотно-основные и нуклеофильные свойства
- •3.4.5 Особенности реакций электрофильного замещения
- •3.4.6. Пятичленные гетероциклы
- •3.4.7 Шестичленные гетероциклы
- •3.4.8. Гетероциклы с двумя гетероатомами
- •3.4.9 Конденсированные гетероциклы
- •4. Биополимеры и их структурные компоненты
- •4.1 Углеводы. Поли-, олиго- и моносахариды.
- •4.1.1. Моносахариды
- •Цикло-оксо-таутомерия
- •Конформации
- •Неклассические моносахариды
- •Химические свойства
- •4.1.2. Олигосахариды
- •4.1.3 Полисахариды
- •4.1.3. Гетерополисахариды
- •4.2 Простые и сложные липиды.
- •4.2.1 Структурные компоненты липидов
- •4.2.2 Простые липиды
- •4.2.3 Свойства липидов и их структурных компонентов
- •4.3 Протеины, пептиды и аминокислоты.
- •4.4 Нуклеиновые и кислоты и нуклеотиды
- •4.4.1. Нуклеотиды
- •4.4.2. Структура нуклеиновых кислот
- •4.4.3. Нуклеотидные коферменты
- •Получение фосфатидилхолинов из яичного желтка
- •Эмульгирование
- •Осаждение фосфатидилхолинов хлористым кадмием
- •Гидролиз фосфатидилхолинов
- •Определение жирных кислот
- •Обнаружение глицерина
- •Обнаружение фосфора
- •Диализ белка
- •Обессоливание белкового раствора методом гель-фильтрации
- •Выделение нуклеопротеинов из дрожжей
- •Опыт №2 Гидролиз нуклеопротеинов. При выполнении данной работы следует соблюдать особую осторожность!
- •5. Физико-химические методы анализа в биоорганической химии
- •5.1 Хроматографические методы анализа
- •5.2 Спектральные методы анализа
- •5.2.1 Основные характеристики электромагнитного излучения
- •5.2.2 Молекулярная спектроскопия
- •5.2.3 Электронная спектроскопия
- •5.2.5 Масс-спектрометрия
- •5.3. Электроанализ в биоорганической химии
- •1. Экстракция липидов из биологического материала.
- •2. Фракционирование липидов методом адсорбционной хроматографии.
4.4.3. Нуклеотидные коферменты
Нуклеотиды имеют большое значение не только как строительный материал для нуклеиновых кислот. Они участвуют в биохими- ческих процессах и особенно важны в роли коферментов,т. е. веществ, тесно связанных с ферментами и необходимых для проявления ими ферментативной активности.
Нуклеозидполифосфаты.
Во всех тканях организма содержатся моно-, ди- и трифосфаты нуклеозидов. Особенно широко известны аденинсодержащие нуклеотиды - аденозин-5'-фосфат (АМР), аденозин-5'-дифосфат (ADP)и аденозин-5'-трифосфат (ATP) (для этих соединений наряду с приведенными сокращенными обозначениями латинскими буквами в оте- чественной литературе используют сокращения соответствующих русских названий - АМФ, АДФ, АТФ).
Нуклеотиды, фосфорилированные в разной степени, способны к взаимопревращениям путем наращивания или отщепления фосфатных групп. Дифосфатная группа содержит одну, а трифосфатная - две ангидридные связи, называемые макроэргическими,поскольку они обладают большим запасом энергии. Необходимые для образования такой связи энергетические затраты восполняются за счет энергии, выделяемой в процессе метаболизма углеводов. При расщеплении макроэргической связи Р~О (обозначаемой волнистой линией) выделяется ~32 кДж/моль. С этим связана важнейшая роль АТФ как «поставщика» энергии во всех живых клетках.
В показанных ниже взаимопревращениях АМФ, АДФ и АТФ формулы этих соединений соответствуют их неионизированному состоянию. В физиологических условиях при рН ~7 фосфатные группы почти полностью ионизированы, поэтому в биохимической литературе эти и любые другие нуклеотиды записывают соответственно в виде анионов.

Нуклеозидполифосфаты в биохимических процессах.
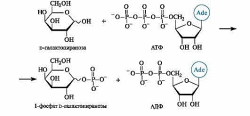
С участием АТФ и АДФ в организме осуществляется важнейший биохимический процесс - перенос фосфатных групп. Например, образование сложных эфиров (фосфатов) - типичная реакция в метаболизме углеводов. Все стадии гликолиза (превращения глюкозы в пируват) осуществляются только в фосфатной форме. Получение фосфатов гидроксилсодержа- щих соединений можно представить в виде общей схемы.

Так, галактоза, образующаяся при расщеплении лактозы, на начальной стадии метаболического превращения в глюкозу взаимо- действует с АТФ с образованием монофосфата.
Никотинамиднуклеотиды.
Наиболее важными представителями этой группы соединений являются никотинамидадениндинуклеотид (NAD, или в русской литературе НАД) и его фосфат (NADP, или НАДФ). Эти соединения выполняют важную роль коферментов в осуществлении многихокислительно-восстановительных реакций. В соответствии с этим они могут существовать как в окисленной (НАД+, НАДФ+), так и восстановленной (НАДН, НАДФН) форме.
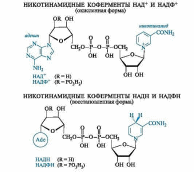
Структурным фрагментом НАД+и НАДФ+является никотинамидный остаток в виде пиридиниевого катиона. В составе НАДН и НАДФН этот фрагмент превращается в остаток 1,4-дигидропиридина.
В ходе биологического дегидрирования субстрат теряет два атома водорода, т. е. два протона и два электрона (2Н+, 2е–) или протон и гидрид-ион (Н+ и Н–). Кофермент НАД+ обычно рассматривается как акцептор гидрид-иона Н- (хотя окончательно не установлено, происходит ли перенос атома водорода к этому коферменту одновременно с переносом электрона или эти процессы протекают раздельно).

В результате восстановления путем присоединения гидрид-иона к НАД+ пиридиниевое кольцо переходит в 1,4-дигидропиридиновый фрагмент. Этот процесс обратим.
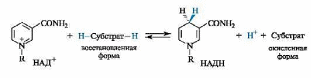
В реакции окисления ароматический пиридиниевый цикл переходит в неароматический 1,4-дигидропиридиновый цикл. В связи с потерей ароматичности возрастает энергия НАДН по сравнению с НАД+. Таким способом НАДН запасает энергию, которая затем расходуется в других биохимических процессах, требующих энергетических затрат.
Типичными примерами биохимических реакций с участием НАД+ служат окисление спиртовых групп в альдегидные, а с участием НАДН - восстановление карбонильных групп в спиртовые.
Вопросы для проверки полученных знаний.
1. Биополимеры и их структурные компоненты
2. Углеводы. Поли-, олиго- и моносахариды.
3. Моносахариды Строение и стереоизомерия Циклические формы
4. Формулы Хеуорса.
5. Дезоксисахара
6. Аминосахара
7. Альдиты
8. Кислые сахара
9. Аскорбиновая кислота (витамин С)
10. Гликозиды.
11. Сложные эфиры.
12. Восстановление Окисление.
13. . Олигосахариды
14. Восстанавливающие дисахариды
15. Невосстанавливающие дисахариды
16. Полисахариды
17. Гомополисахариды
18. Крахмал
19. Гликоген.
20. Целлюлоза
21. Гетерополисахариды
22. Простые и сложные липиды
23. Простые липиды
24. Жиры и масла
25. Сложные липиды
26. Свойства липидов и их структурных компонентов
27. Протеины, пептиды и аминокислоты.
28. α-Аминокислоты
29. Аналитически важные реакцииα-аминокислот
30. Первичная структура пептидов и белков
31. Строение пептидной группы
32. Строение и номенклатура пептидов
33. Вторичная структура полипептидов и белков
34. Нуклеиновые и кислоты и нуклеотиды
35. . Нуклеотиды
36. Нуклеозиды
37. Циклофосфаты.
38. Структура нуклеиновых кислот
39. Вторичная структура ДНК.
40. Нуклеотидные коферменты
41. Нуклеозидполифосфаты в биохимических процессах.
ЛАБОРАТОРАЯ РАБОТА № 14. МОНОСАХАРИДЫ
Опыт № 1. Доказательство наличия гидроксильных групп в D-глюкозе
В пробирку поместите 1 каплю 0,5% раствора D-глюкозы и 6 капель 10% гидроксида натрия NaOH. К полученной смеси добавьте 1 каплю 2% раствора сульфата меди(II) CuSO4.Образующийся осадок гидроксида меди (II) CuSO4быстро растворяется и получается прозрачный раствор синего цвета. Полученный раствор сохраните для следующего опыта.
Опыт № 2. Восстановление гидроксида меди(II) глюкозой в щелочной среде
К полученному в предыдущем опыте синему раствору добавьте несколько капель воды до высоты слоя жидкости в пробирке 18-20 мм.Нагрейте ее над пламенем горелки, держа пробирку наклонно так, чтобы нагревалась только верхняя часть раствора, а нижняя оставалась для контроля. Нагрейте только до начала кипения, но не кипятите. При нагревании цвет верхней части раствора изменяется от синего до желто-красного.
Опыт № 3. Восстановление аммиачного раствора гидроксида серебра глюкозой
В пробирку поместите 1 каплю 5% нитрата серебра AgNO3, прибавьте 2 капли 10% гидроксида натрия NaOH и 3-4 капли 10% водного раствора аммиака до растворения образующегося осадка гидроксида серебра. Полученный прозрачный аммиачный раствор гидроксида серебра является реактивом, окисляющим глюкозу.
Добавьте к полученному реактиву 1 каплю 0,5 % раствора глюкозы и слегка подогрейте пробирку над пламенем горелки до начала побурения раствора. Далее реакция идет без нагревания, и металлическое серебро выпадаетлибо в виде черного осадка, либо осаждается на стенках пробирки в виде блестящего зеркального налета.
Опыт № 4 . РеакцияСелеванована фруктозу
В пробирку поместите крупинку сухого резорцина и 2 капли концентрированной хлороводородной кислоты. Добавьте 2 капли 0,5 % раствора фруктозы и нагрейте до началакипения. Постепенно жидкость приобретает красное окрашивание.
ЛАБОРАТОРНОЕ ЗАНЯТИЕ № 15. ДИСАХАРИДЫ
Опыт № 1. Отсутствие восстанавливающей способности у сахарозы
В пробирку поместите 1 каплю 1% раствора сахарозы и 6 капель 10% гидроксида натрия. Добавьте для разбавления 5-6 капель воды(2 см). Прибавьте 1 каплю сульфата меди (II)CuSO4. Образуется прозрачный синий раствор комплексной соли меди с сахарозой. Осторожно нагрейте пробирку над пламенем грелки так, чтобы нагревалась только верхняя часть раствора, а нижняя оставалась без нагревания. Нагревайте только до кипения, но не кипятите. Изменения окраски раствора не происходит.
Опыт № 2. Гидролиз сахарозы.
В две пробирки поместите по 10 капель раствора сахарозы.
В одну пробирку добавьте 1 – 2 капли 10 %–го раствора серной кислоты.
Пробирку с подкисленным раствором сахарозы поставьте в почти кипящую водяную баню. Через 20 минут пробирку достаньте и охладите.
В обе пробирки прибавьте по 1 капле раствора сульфата меди и по каплям прибавляйте 10 %–й раствор гидроксида натрия до появления интенсивно–синей окраски, свидетельствующий о полной нейтрализации кислоты.
Нагрейте обе пробирки на водяной бане. В обеих ли пробирках появилась оранжево–желтая окраска?
Опыт № 3. Восстанавливающая способность лактозы
В пробирку поместите 1 каплю раствора лактозы и 4 капли 10% гидроксида натрия. Добавьте 1 каплю 2% сульфата меди. Образующийся голубой осадок гидроксида меди при встряхивании пробирки растворяется, образуя синий раствор комплексной соли меди с лактозой. Добавьте для разбавления несколько капель воды до высоты слоя жидкости 18-20 м. Осторожно нагреть пробирку над пламенем горелки так, чтобы нагревалась только верхняя часть , а нижняя оставалась без нагревания. Нагревать до кипения. При нагревании цвет верхней части раствора изменяется в желто-красный.
ЛАБОРАТОРНАЯ РАБОТА № 16. ПОЛИСАХАРИДЫ.
Опыт № 1. Качественная реакция на крахмал
В пробирку поместите 5 капель 0,5% крахмального клейстера и 1 каплю сильно разбавленного раствора йода. Раствор окрашивается в красный цвет. Нагрейте раствор, он обесцвечивается; при охлаждении окраска восстанавливается.
Опыт № 2. Кислотный гидролиз крахмала
В пробирку поместите 1 каплю 0,5% клейстера. Добавьте 2 капли 10% серной кислоты и поместите пробирку в кипящую водяную баню. Мутный раствор клейстера становится прозрачным через 20 минут. Пипеткой нанесите 1 каплю гидролизата на предметное стекло и добавьте 1 каплю разбавленного йода в йодиде калия.
Если проба не дает положительный йодкрахмальной реакции, добавьте в пробирку 8 капель 10% гидроксида натрия для создания щелочной среды. Затем добавьте 1 каплю 2% сульфата меди (II) CuSO4. Будет ли положительной проба Троммера.
Опыт № 3. Ферментативный гидролиз крахмала
Фермент амилаза, содержащийся в слюне, соке поджелудочной железы, крови, печени, мозге, катализирует гидролиз крахмала. Последовательно процесс расщепления крахмала можно представить следующим образом.

Реактивы:раствор слюны (свежую слюну разводят дистиллированной водой в 5 раз); 1 %-й раствор крахмала; раствор иода в иодиде калия (1 г KI растворяют в нескольких миллилитрах воды.В концентрированном растворе соли растворяют 1 г иода и разбавляют водой до 300 см3.); 5 %-й раствор гидроксида натрия; 5 %-й раствор сульфата меди.
Оборудование: пробирки; водяная баня.
Ход работы
Гидролиз крахмала.
В две пробирки налейте по 2 см31 %-го раствора крахмала.
В одну пробирку долейте 1 см3 разведенной слюны, а в другую – 1 см3воды (для контроля) и поставьте пробирки на 10 мин. в водяную баню или термостат, нагретые до 37–38оС (внимательно следите за температурой, не допуская ее повышения).
По окончании реакции проанализируйте содержимое пробирок на содержание крахмала и мальтозы
Обнаружение продуктов гидролиза крахмала.
Из опытной и контрольной пробирок задания 1 отлейте в отдельные пробирки по 1 см3растворов.
Добавьте в каждую пробирку по 1 капле раствора иода и перемешайте.
Сравните окраску полученных растворов.
Обнаружение мальтозы.
К оставшимся растворам опытной и контрольной пробирок добавьте по 1 капле раствора сульфата меди и по 5 капель раствора щелочи.
Содержимое пробирок перемешайте и поместите их в кипящую водяную баню.
Сравните окраску полученных растворов.
Оформление результатов.
Запишите схемы частичного и полного гидролиза крахмала. Объясните полученные результаты.
Опыт № 4. Обнаружение крахмала в продуктах питания
Крахмал основной резервный углевод растений, представляет смесь двух полисахаридов, линейного (амилозы) и разветвленного (амилопектина), дает цветную реакцию с раствором иода в иодиде калия – окрашивается в темно–синий цвет. Крахмал белое аморфное вещество, не растворимое в холодной воде, выделяют из картофеля.
Материалы и реактивы: крахмал; картофель; отварной рис; мука; яблоко; лимон; растительное масло; раствор иода в иодистом калии (1 г иодистого калия растворяют в нескольких миллилитрах воды, в концентрированном растворе соли растворяют 1 г иода и разбавляют водой до 300 см3) или спиртовой раствор иода; дистиллированная вода.
Оборудование: пробирки; ступка с пестиком.
Ход работы
Исследуемые твердые продукты (картофель, отварной рис, яблоко, лимон) по отдельности разотрите до кашецообразного состояния в ступе.
В семь пронумерованных пробирок поместите по 0,5 –1 г растертых продуктов.
Во все пробирки добавьте по 2 – 3 см3 дистиллированной воды и пробы тщательно перемешайте.
Добавьте в пробирки по 1 – 2 капли раствора иода.
Отметьте пробирки, в которых наблюдается синее окрашивание.
Оформление результатов
Оформите проведенные исследования в виде таблицы. Сделайте вывод о содержании крахмала в изученных продуктах.
№ пробирки |
Исследуемый продукт |
Наблюдаемая окраска |
Содержание крахмала |
|
|
|
|
Опыт №5. Гидролиз целлюлозы.
При выполнении этого задания необходимо соблюдать особую осторожность!
Поместите в пробирку мелкоизмельченный кусочек фильтровальной бумаги и добавьте 1–3 капли (ОСТОРОЖНО!) концентрированной серной кислоты так, чтобы кислота смочила бумагу.
Смесь осторожно нагрейте (обычно достаточно тепла руки) до почти полного растворения целлюлозы.
К полученному раствору добавьте 10 капель воды, хорошо перемешайте и поместите пробирку в кипящую водяную баню на 30 минут.
По окончании реакции к небольшой порции раствора прибавьте 1 каплю раствора сульфата меди и по каплям добавляйте 10 %–й раствор гидроксида натрия до появления интенсивно–синей окраски.
Нагрейте пробирку на водяной бане. Появляется оранжево–желтая окраска.
Оформление результатов
Оформите проведенные исследования в виде таблицы. Сделайте выводы о структуре полисахаридов и продуктах его гидролиза.
№ задания |
Исследуемое вещество |
Наблюдаемое явление |
Вывод |
|
|
|
|
ЛАБОРАТОРНАЯ РАБОТА № 17. ЛИПИДЫ
Опыт№1. Гидролиз (омыление) жира.
Ход работы: К 10 каплям растительного масла добавьте 0,5 мл насыщенного спиртового раствора КОН. Смесь нагрейте на кипящей водяной бане не менее 20 минут, при этом образуется гидролизат (использовать для опыта 2).
В выводе отметьте:
-напишите уравнение реакции, дайте название полученным продуктам
Опыт № 2 - Окисление олеиновой кислоты раствором перманганата калия
В пробирку поместите 2 капли олеиновой кислоты, добавьте 2 капли 5 % раствора карбоната натрия Na2CO3и 2 капли 2 % раствора перманганата калия KMnO4.Встряхните пробирку несколько раз. Отметьте, какие изменения происходят с первоначальной фиолетовой окраской раствора.
Опыт № 3 Исследование продуктов гидролиза жира.
а) выделение высших карбоновых кислот
К части гидролизата добавьте 0,5 мл. 10% - серной кислоты, слегка нагрейте. Всплывает маслянистый белый слой жирных кислот. К оставшейся части гидролизата добавьте 2 мл дистиллированной воды и энергично встряхните.
б) открытие глицерина
Поместите в пробирку 2 капли 2% раствора CuSO4 и 2 капли 10% раствора NaOH и перемешайте. К образовавшемуся гидроксиду меди добавьте половину разбавленного гидролизата, осадок растворится и появится окрашивание - образовался глицерат меди (II).
в) получение свинцового мыла
К оставшейся части гидролизата добавьте 0,5 мл 10% раствора (СН3СОО)2Рb. Получилось нерастворимое свинцовое мыло.
В выводе отметьте:
- напишите уравнения реакций,
-объясните появление синего окрашивания.
Опыт № 4. Определение общего содержания липидовв тканях
Цель работы:ознакомиться с весовым методом определения общего содержания липидов в тканях.
Принцип метода.Липиды экстрагируют из тканей смесью Фолча, экстракт отмывают от нелипидных примесей солевым раствором. Количественное определение суммарных липидов проводят весовым методом.
Реактивы:
1. Хлороформ.
2.Метанол.
3. Смесь хлороформ – метанол в соотношении 2:1 по объему (смесь №1).
4. NaCl 0,73 % водный раствор (можно заменить 0,88 % KCl, 0,05 % CaCl2).
5. Смесь растворителей, содержащая минеральные соли: хлороформ-метанол-водный раствор NaCl (0,58 %) или KCl (0,74 %) или СаС12 (0,04 %) в соотношении 3:48:47 (смесь №2).
Оборудовани: пробирки, гомогенизатор, центрифуга, сушильный шкаф, аналитические весы.
Ход работы
Измельченную на холоде навеску ткани (200 – 250 мг мозга, 300 – 500 мг других тканей) помещают в гомогенизатор с тефлоновым или стеклянным пестиком, заливают 5 объемами смеси №1 и гомогенизируют в течение 5 мин. Экстракт отделяют от биомассы, сливают в мерный цилиндр. Процедуру повторяют еще 2 – 3 раза. Измельченную ткань вместе с экстрактом количественно переносят в мерный цилиндр (конечное разведение ткани 1:20), перемешивают и через 20 мин фильтруют через обезжиренный фильтр или центрифугируют при 1000 gв течение 15 – 20 мин K центрифугату добавляют 0,73 %–й водный раствор хлорида натрия в объеме, составляющем 20 % от объема экстракта липидов. Экстракт перемешивают и центрифугируют при 600gв течение 15 – 20 мин. После центрифугирования система разделяется на две фазы. Верхнюю фазу осторожно декантируют с помощью шприца и пипетки с оттянутым концом, отбрасывают. Поверхность нижней фазы и внутренние стенки центрифужной пробирки ополаскивают 3 мл смеси №2, тщательно следя за тем, чтобы не было перемешивания нижней фазы и промывной смеси. Последнюю отбрасывают и промывание повторяют еще 2 раза. После удаления промывной смеси к нижней фазе, т.е. к хлороформному раствору липидов, прибавляют по каплям метанол до образования однофазной системы, раствор перемешивают.
Количество липидов определяют весовым методом. Для этого круглодонную колбу для роторного испарителя доводят до постоянного веса, помещают в нее экстракт липидов, содержащий не менее 10 – 20 мг липидов, растворитель упаривают на роторном испарителе. Колбу с осадком липидов доводят до постоянного веса в вакуумэксикаторе над KOH. Путем повторного взвешивания определяют вес осадка липидов и рассчитывают содержание липидов в тканях в процентах с учетом взятой навески. Взвешивание проводят на аналитических весах.
Опыт №5. Определение йодного числа
Реактивы: 1) жиры; 2) спирт этиловый; 3) йод, 0,1 н раствор в спирте; 4) гипосульфит, 0,1н раствор; 5) крахмал, 0,5% раствор.
Принцип метода: Ненасыщенность жира зависит от присутствия в его составе непредельных жирных кислот. Ненасыщенные соединения легко присоединяют по 2 атома галогена по месту каждой двойной связи. Обычно степень ненасыщенности определяется йодным числом. Йодное число измеряется количеством йода, которое присоединяется к 100 г жира. Йодное число позволяет судить о степени ненасыщенности жира, о склонности его к "высыханию", прогорканию и др.
Ход работы: Отвешивают в коническую колбочку на 50 мл 0,1 г жира и вносят 10 мл хлороформа (проба). В другую пустую колбочку добавляют 10 мл хлороформа (контроль). В обе колбы приливают точно по 25 мл 0,1н. спиртового раствора йода. Закрывают пробкой, тщательно перемешивают и оставляют в темном месте на 90 минут. Не вошедший в реакцию йод титруют 0,1н раствором гипосульфита сначала до слабо-желтой окраски, а затем в присутствии крахмала до обесцвечивания раствора, потом таким же образом титруют контроль.
Расчет: 1 мл 0,1 н раствора гипосульфита эквивалентен 1 мл 0,1 н раствора йода или 0,0127 г йода. Зная, сколько мл 0,1 н раствора гипосульфита пошло на титрование контроля и опыта, вычисляют йодное число:

где: А - количество 0,1 н раствора гипосульфита, затраченное на титрование контроля;
В - количество 0,1 н раствора гипосульфита, затраченное на титрование пробы;
f - коэффициент поправки на 0,1н раствор гипосульфита;
с - навеска жира в граммах.
Опыт №6. Определение числа омыления жира
Реактивы: 1) жир; 2) КОН, 0,5 н. спиртовой раствор; 3) HCl, 0,5 н раствор; 4) фенолфталеин, 0,1 % раствор.
Принцип метода: Числом омыления называется количество мг КОН, необходимого для нейтрализации всех свободных и связанных жирных кислот, содержащихся в 1 г жира.
Ход работы: В колбочку на 50 мл вносят 0,5 г жира, прибавляют 15 мл 0,5н спиртового раствора КОН и кипятят на водяной бане 50 минут с обратным холодильником, время от времени взбалтывая содержимое колбы. Окончание омыления определяется по образованию однородной прозрачной жидкости. Одновременно ставят контроль, но вместо жира прибавляют 0,5 мл воды. По окончании омыления жидкость охлаждают до комнатной температуры, добавляют 20 мл дистиллированной воды и титруют 0,5 н раствором HCl по фенолфталеину.
Расчет: 1 мл 0,5 н раствора КОН соответствует 25 мг КОН. Количество КОН, которое пошло на нейтрализацию всех жирных кислот 1 г жира, равно:

где: В - количество 0,5 н раствора HCl, затраченное на титрование контроля; А - количество 0,5 н раствора HCl, затраченное на титрование пробы; m - количество жира в граммах; f - коэффициент поправки на 0,5 н раствор HCl.
Опыт №7. Определение кислотного числа
Реактивы: 1) жир; 2) смесь спирта с эфиром; 3) КОН, 0,1 н раствор; 4) фенолфталеин. 0,1 % раствор.
Принцип метода: Кислотным числом называется число мг КОН, необходимого для нейтрализации всех свободных жирных кислот в 1 г жира.
Ход работы: Отвешивают на весах 1 г жира, помещают в колбу на 50 мл, добавляют 10 мл нейтральной смеси спирта с эфиром и 3-4 капли фенолфталеина. Раствор масла в смеси спирта с эфиром титруют из обычной бюретки КОН до нежно-розового цвета.
Расчет: Количество КОН в мг, которое пошло на титрование свободных жирных кислот в 1 г жира, равняется:

где: А - количество 0,1н раствора КОН, затраченное на титрование пробы;
f - коэффициент поправки на 0,1н раствор КОН;
5,6 - количество мг КОН, содержащееся в 1 мл 0,1 н раствора КОН;
m - количество жира в граммах.
Опыт №8. Определение эфирного числа жира.
Эфирным числом называется количество КОН, необходимое для нейтрализации жирных кислот, которые образуются при омылении 1 г жира. Это число определяют как разницу между числом омыления данного жира и его кислотным числом.
Опыт №9 . Доказательствонепредельноститерпенов
В пробирку поместите 2 капли бромной воды и 1 каплю скипидара, встряхните. Водный слой обесцвечивается.
Опыт № 10. Реакция Сальковского
Реактивы: 1) холестерин, 1% раствор в хлороформе; 2) уксусный ангидрид; 3) серная кислота, конц.
Принцип метода: метод основан на дегидратации молекулы холестерина под действием концентрированной серной кислоты с образованием холестерилена, имеющего красную окраску.


Ход работы: В сухую пробирку наливают 10 капель 1% хлороформного раствора холестерина и добавляют равный объем концентрированной серной кислоты (осторожно по стенке пробирки). При легком встряхивании на границе 2-х слоев жидкости образуется оранжевое кольцо, которое при стоянии переходит в красное. Нижний слой серной кислоты приобретает зеленую флуоресценцию.
Опыт №10 . Реакция Либермана - Бурхарда
Реактивы: 1) холестерин, 1% раствор в хлороформе; 2) уксусный ангидрид; 3) серная кислота, конц.
Ход работы: В сухую пробирку наливают 10 капель 1% хлороформногораствора холестерина, добавляют 3-5 капель уксусного ангидрида и 1-2 капли концентрированной серной кислоты.
Содержимое пробирки осторожно встряхивают и помещают в баню при температуре 40оС на 1-2 минуты или оставляют при комнатной температуре на 5-10 минут. В присутствии холестерина вначале появляется красное окрашивание, которое затем переходит в фиолетовое, синее и зеленое. При незначительном содержании холестерина в растворе сразу появляется зеленое окрашивание.
