
- •Н.Ф. Клещев., н.В. Решетняк, н.М. Мартынюк Биоорганическая химия. Практикум
- •Центрифуги
- •1. Общая характеристика органических соединений.
- •Валентные состояния атома углерода
- •Концепция электронных смещений
- •Получение цис - и транс - бутен-2-овой кислот
- •2. Химические свойства органических соединений
- •Зависимость кислотности от гетероатома.
- •Влияние углеводородного радикала и присутствующих в нем заместителей
- •Влияние растворителя.
- •Основные свойства органических соединений. Π-основания и n-основания.
- •Теория Льюиса.
- •Механизм радикального замещения в общем виде
- •Определение степени окисления атомов в органических веществах
- •Окисление и восстановление органических веществ
- •3. Биологически важные органические соединения
- •3.1 Полифункциональные соединения в процессах жизенедеятельности
- •3.1.1 Общая характеристика.
- •3.1.2. Реакционная способность и специфические реакции многоатомных спиртов и фенолов
- •3.1.3 Реакционная способность и специфические реакции дикарбоновых кислот
- •3.1.5. Функциональные производные угольной кислоты
- •3.2.1 Общая характеристика
- •3.3. Реакционная способность и специфические свойства биологически важныхгетерофункциональных соединений
- •3.3.1. Аминоспирты
- •3.3.3. Гидрокси- и аминокислоты
- •3.3.4. Оксокислоты
- •3.4. Гетерофункциональные производные бензола как лекарственные средства
- •3.4 Важнейшие гетероциклические биоорганические соединения.
- •3.4.1. Общая характеристика
- •3.4.2. Номенклатура
- •3.4.3. Реакционная способность ароматических гетероциклов
- •3.4.4. Кислотно-основные и нуклеофильные свойства
- •3.4.5 Особенности реакций электрофильного замещения
- •3.4.6. Пятичленные гетероциклы
- •3.4.7 Шестичленные гетероциклы
- •3.4.8. Гетероциклы с двумя гетероатомами
- •3.4.9 Конденсированные гетероциклы
- •4. Биополимеры и их структурные компоненты
- •4.1 Углеводы. Поли-, олиго- и моносахариды.
- •4.1.1. Моносахариды
- •Цикло-оксо-таутомерия
- •Конформации
- •Неклассические моносахариды
- •Химические свойства
- •4.1.2. Олигосахариды
- •4.1.3 Полисахариды
- •4.1.3. Гетерополисахариды
- •4.2 Простые и сложные липиды.
- •4.2.1 Структурные компоненты липидов
- •4.2.2 Простые липиды
- •4.2.3 Свойства липидов и их структурных компонентов
- •4.3 Протеины, пептиды и аминокислоты.
- •4.4 Нуклеиновые и кислоты и нуклеотиды
- •4.4.1. Нуклеотиды
- •4.4.2. Структура нуклеиновых кислот
- •4.4.3. Нуклеотидные коферменты
- •Получение фосфатидилхолинов из яичного желтка
- •Эмульгирование
- •Осаждение фосфатидилхолинов хлористым кадмием
- •Гидролиз фосфатидилхолинов
- •Определение жирных кислот
- •Обнаружение глицерина
- •Обнаружение фосфора
- •Диализ белка
- •Обессоливание белкового раствора методом гель-фильтрации
- •Выделение нуклеопротеинов из дрожжей
- •Опыт №2 Гидролиз нуклеопротеинов. При выполнении данной работы следует соблюдать особую осторожность!
- •5. Физико-химические методы анализа в биоорганической химии
- •5.1 Хроматографические методы анализа
- •5.2 Спектральные методы анализа
- •5.2.1 Основные характеристики электромагнитного излучения
- •5.2.2 Молекулярная спектроскопия
- •5.2.3 Электронная спектроскопия
- •5.2.5 Масс-спектрометрия
- •5.3. Электроанализ в биоорганической химии
- •1. Экстракция липидов из биологического материала.
- •2. Фракционирование липидов методом адсорбционной хроматографии.
1. Общая характеристика органических соединений.
1.1 Основные понятия и классификация органических соединений
Органические соединения— класс химических соединений, в состав которых входит углерод (за исключением оксидов углерода,карбидов,угольной кислоты,карбонатов и цианидов).
Название «органические соединения» появилось на ранней стадии развития химии и говорит само за себя – ученые той эпохи считали, что живые существа состоят из особых органических соединений.
Классификация органических соединений
1. По строению углеродного скелета.
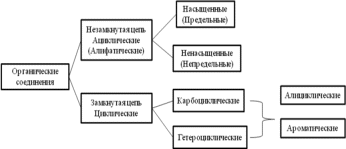
2. По функциональным группам.
Функциональная группа– атом или группа атомов определяющие принадлежность к определенному классу и ответственные за его химические свойства.
Основные функциональные группы
№п/п |
Функциональная группа |
Класс соединения |
|
обозначение |
название группы |
||
1 |
|
карбоксил |
Карбоновые кислоты |
2 |
-SO3H |
сульфо |
Сульфоновые кислоты |
3 |
N-С |
циано |
Нитрилы |
4 |
|
карбонил |
Альдегиды Кетоны |
5 |
-ОН- |
гидроксил |
Спирты, фенолы |
6 |
-SH |
меркапто. |
Меркатаны (тиолы) |
7 |
-NH2 |
амино |
Амины |
8 |
R-O-R' |
Простые эфиры |
|
9 |
R-C(O)O-R' |
Сложные эфиры |
|
Гомологический ряд – это группа родственных органических соединений с однотипной структурой, каждый последующий член которой отличается от предыдущего на гомологическую разность (СН2)n.
Особенности строения атома углерода
1. Четыре валентных орбитали. Четыре свободных электрона. Максимальная ковалентность (IV). Самый малый радиус. Самые прочные связи.
2. Атом углерода способен к ковалентному связыванию как с электроположительными, так и с электроотрицательными элементами.
3. Атом углерода образует химические связи с высокими значениями энергии.
-
С-С
348 кДж/моль
N-N
250кДж/моль
Si-Si
226кДж/моль
С-Н 415кДж/моль
S-S
225кДж/моль
С-O
360кДж/моль
O-O
146кДж/моль
На углеродном остове могут прочно «крепиться» самые разнообразные функциональные группировки.
Атом углерода способен к катенации (формирование циклов, цепей любой длины и разветвлённости).
4. Атом углерода обладает сопоставимой величиной энергий s- и p- орбиталей. (Переход атома в возбужденное состояние, три валентных состояния –sp3-,sp2- и sp- гибридизация).
Сравнительная характеристика неорганических и органических соединений представлена в таблице 1.
1.2 Теории строения органических веществ. Изомеризация, виды изомеризации.
Теория строения органических соединений. 1861 г. А.М. Бутлеров
«Химическая натура сложной частицы определяется натурой элементарных составных частей, количеством их и химическим строением».
Таблица 1- Сравнительная характеристика органических и неорганических соединений и реакций с их участием
Неорганические соединения |
Органические соединения |
Высокополярны. Часто солеобразны. Хорошо растворимы в воде. Их растворы и расплавы электропроводны. Имеют высокие Тпл, Ткип. В реакции вступают легко, реагируют очень быстро. Для успешного осуществления реакций не требуются особые условия (температура, катализатор и др.). Выходы в реакциях высокие. |
Малополярны. Не растворимы в воде. Неэлектролиты. Имеют низкие Тпл, Ткип. В реакции вступают плохо, реагируют очень медленно. Для успешного осуществления реакций требуются особые условия (температура, катализатор, облучение и др.) – дополнительная энергия для разрыва и образования ковалентных связей. Выходы в реакциях низкие. Часто образуется смесь изомеров, т.к. одновременно протекают несколько конкурирующих реакций по разным реакционным центрам субстрата. |
Основная причина отличий в свойствах – природа связи в молекулах |
|
Ионная |
Ковалентная |
Положения теории:
1. Атомы в молекулах соединяются друг с другом в определённой последовательности, согласно их валентности. Эта последовательность атомов называется химическим строением.
Структурная формула – изображение химических связей в молекуле с учетом их валентности.
2. Свойства органических веществ зависят не только от их качественного и количественного состава, но и от того, в каком порядке соединены атомы в молекулах, т.е. от химического строения.
3. Атомы в молекулах взаимно влияют друг на друга.
4. Свойства органических веществ определяются их строением, и, наоборот, зная свойства, можно прогнозировать строение веществ.
Физические и химические свойства органических соединений определяются составом их молекул, а также химическим, пространственным и электронным строением.
Изомерия органических соединений
Изомерия– явление существования веществ с одинаковым качественным и количественным составом, но различными свойствами (1830 г. Берцелиус).
Причина изомерии стала понятной лишь после появления теории химического строения А.М. Бутлерова (1861 г.) – различное строение молекул, обусловленное способностью атома углерода к образованию 4-хковалентных связей, в том числе и с др. атомами углерода.

Виды изомерии |
|
Структурная: – обусловлена разным порядком соединения атомов в молекуле. |
Пространственная(стереоизомерия): – обусловлена различным расположением заместителей относительно друг друга в пространстве. |
1. С-скелета; |
1. Геометрическая; |
2. Положения: |
2. Оптическая; |
а) кратных связей; |
3. Конформационная; |
б) заместителей; |
4. Конфигурационная. |
в) функциональных групп; |
|
3. Межклассовая; |
|
4. Таутомерия. |
|
Структурная изомерия
Количество изомеров С-скелета очень быстро возрастает с увеличением числа С-атомов:
Гексан (6) |
5 изомеров |
Гептан (7) |
9 изомеров |
Октан (8) |
18 изомеров |
Нонан (9) |
35 изомеров |
Декан (10) |
75 возможных изомеров |
Эйкосан (20) |
366315 возможных изомеров |
В случае циклоалканов изомерия скелета может быть обусловлена различным числом атомов углерода в кольце: |
|
Изомерия положения


Свойства структурных изомеров
Структурные изомеры существенно различаются между собой физическими, химическими и физиологическими свойствами.
- Ткипу разветвленных алканов ниже, чем у неразветвленных.
- Тплвыше у тех изомеров, которые имеют более симметричную структуру.
Разные физиологические свойства |
Разные химические свойства |
α-нафтиламинβ-нафтиламин вызывает рак мочевого пузыря |
|
Таутомерия
«таутос» - тот же самый, «мерос» - доля, часть (греч.).
Таутомерия – явление динамического обратимого превращения изомеров, протекающее с разрывом и образованием связей и сопровождающееся перемещением атомов (чаще всего протона) и реже групп атомов.
Изомерные формы – таутомеры.
В отличие от структурных изомеров, таутомеры, как правило, не могут существовать отдельно друг от друга. Независимое их получение невозможно.
Основным признаком таутомерных веществ является их двойственное реагирование – способность к образованию двух рядов производных как результат раздельного и самостоятельного реагирования двух находящихся в равновесии изомерных форм одного соединения.
Виды таутомерии
1. Кето-енольная таутомерия: |
|
2. Амид-имидольная таутомерия: |
|
3. Кольчато-цепная таутомерия– равновесие линейной и кольчатой (полуацетальной форм) |
|
Геометрическая изомерия
- разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах пары заместителей относительно плоскости двойной связи или цикла.
Обусловлена тем, что в молекулах этих веществ свободное вращение атомов вокруг σ-связей (циклоалканы) и относительно π-связей (алкены) оказывается невозможным.




Z,E-номенклатура (для три- и тетразамещенных алкенов).
Конфигурацию изомера определяют по относительному расположению старших заместителей. По одну сторону плоскости – Z-изомер; по разные – Е-изомер.
В основе определения старшинства находится атомный номер элемента. В случае одинаковых атомов старшинство группы определяет «вторая оболочка» атомов:
-СН3< -СН2СН3< -СН(СН3)2< -СН2NН2< -CH2OH< -CH2F
В случаях групп с различным типом связи старшинство увеличивается в рядах:
-CH2OH < -COH < COR < COOH
-CH2NH2< -CH=NH < -CN

Е-изомер Z-изомер
Вследствие того, что расстояния между заместителями в молекулах изомеров различны, последние существенно различаются своими химическими и физическими свойствами. Они могут быть разделены и существовать индивидуально.

Переход одного изомера в другой – изомеризация протекает обычно при нагревании или облучении.
Конформационная изомерия
- разновидность стереоизомерии, которая определяется различием пространственного расположения в молекулах заместителей, возникающее в результате свободного вращения вокруг σ-связей.
Такие изомеры различаются между собой стабильностью. Более стабильные конформации, которые фиксируются физико-химическими методами, называются конформерами.
Конформер– это молекула в конформации, в которую её атомы самопроизвольно возвращаются после небольших сдвигов. |
|
Изображение конформеров – проекции Ньюмена:

Чем больше сила взаимного отталкивания атомов водорода, тем выше энергия системы; поэтому заторможенной конформации будет соответствовать минимум потенциальной энергии молекулы.
Принимая различные конформации, молекулы остаются химически однородными; конформации не являются типичными изомерами. Однако, в некоторых случаях (при тесной упаковке молекул), можно разделить различные формы.
Конформации биоорганических молекул (ферменты, витамины, белки, нуклеиновые кислоты) играют определяющую роль в проявлении последними биологической активности.
Коформации в ряду циклических углеводородов:

Конфигурационная изомерия
Объёмные структуры циклических соединений содержат разные по природе положения заместителей:
|
а – аксиальные (попеременно направлены в противоположные стороны от плоскости кольца) |
|
е – экваториальные (направлены радиально от плоскости и попеременно в противоположные стороны) |
Оптическая изомерия
Некоторые органические соединения являются оптически активными. Они способны изменять плоскость поляризации света при прохождении его через образец вещества (1815 г. Ж. Био).
Свет – электромагнитные волны, колебания которых перпендикулярны направлению их распространения. В естественном (солнечном) свете эти колебания происходят в различных плоскостях.

Оптически активные соединения поворачивают плоскость поляризации на определённый угол вправо (правовращающие) или влево (левовращающие).
Изомеры, вращающие плоскость поляризации в разные стороны, но на один и тот же угол – антиподы (энантиомеры).
Рацемическая смесь (рацемат) – смесь, состоящая из равных количеств лево- и правовращающих изомеров. Рацемат оптически не активен.
Оптическая активность характерна для соединений содержащих sp3-гибридный атом (объёмные молекулы). Если такой атом связан с четырьмя различными заместителями, то возникают изомерные пары, в которых молекулы изомеров относятся по своей пространственной организации одна к другой так же, как соотносятся между собой предмет и зеркальное изображение.
Изображение энантиомеров

Для того, чтобы связать строение с вращением, было предложено выбрать соединение-стандарт и сравнить с ним все другие соединения, содержащие хиральный центр. В качестве стандарта был выбран 2,3-диоксипропаналь (глицериновый альдегид):

R,S- номенклатура
Для отнесения стереоизомера необходимо определить в нем старшинство заместителей (порядковый номер элемента – как в случае Z,E-изомерии). Взгляд наблюдателя направляется по оси С-младший заместитель (Н). После такой ориентации смотрят, как три заместителя располагаются в ряд в направлении от старшего к младшему. В случаеR-конфигурации этот порядок соответствует направлению движения по часовой стрелке, в случаеS-конфигурации – против часовой стрелки.

Если молекуле имеется несколько хиральных центров, то число изомеров возрастает и равняется 2n, гдеn-число хиральных центров.

В отличие от структурных изомеров энантиомеры идентичны один другому в большинстве своих свойств. Они отличаются только по своему взаимодействию с плоскополяризованным светом и взаимодействием с веществами, которые также являются хиральными.
В организме реакции протекают с участием биокатализаторов - ферментов. Ферменты построены из хиральных молекул α-аминокислот. Поэтому они играют роль хиральных реагентов, чувствительных к хиральности взаимодействующих с ними субстратов (стереоспецифичность биохимических процессов). Это приводит к тому, что хиральные природные соединения представлены, как правило, лишь одной стереоизомерной формой (D-углеводы,L-аминокислоты).
Стереоспецифичность лежит в основе проявления биологического действия одним из энантиомеров, в то время, как другой изомер может быть неактивным, а иногда оказывать иное или даже противоположное действие.
1.3 Химическая связь в органических соединениях
В соответствии с квантово-химическими представлениями углерод в соединениях должен быть двухвалентным. |
|
Однако, в подавляющем большинстве своих соединений атом углерода имеет валентность IV. Это происходит за счет разъединения («распаривания») пары электронов с 2sподуровня. |
|
При образовании химической связи выделяется энергия, поэтому появление двух новых валентных возможностей приводит к выделению дополнительной энергии (1053,4 кДж/моль), которая превосходит энергию, затраченную на распаривание 2sэлектронов (401 кДж/моль).
Различные по форме орбитали (s,p) при образовании связи смешиваются, давая новые равноценные гибридизованные орбитали (теория гибридизации, Л.Полинг, Д.Слэтер, 1928-1931 гг.). Понятие гибридизации относится только к молекулам, но не к атомам, и в гибридизацию вступают только орбитали, а не электроны на них.
В отличие от негибридизованных s- иp- орбиталей гибридная орбиталь полярна (электронная плотность смещена) и способна образовывать более прочные связи.











