
- •Термодинамикалық жүйе және жұмыс денесі. Термодинамикалық параметрлер және күй теңдеуі.
- •1 Моль газ үшін Менделеев-Клапейрон теңдеуі
- •Тепе-теңдік күй және процесс.
- •Ішкі энергия күй функциясы ретінде.
- •Термодинамикадағы жұмыс. Жылу.
- •Термодинамиканың бірінші бастамасының теңдеуі.
- •Жылусыйымдылық түсінігі. Ағындар үшін термодинамиканың бірінші бастамасы. Ағындар жұмысының түрлері.
- •Идеал газдардың термодинамикалық процестері .
- •Идеал газ заңдары
- •Идеал газдар қоспасы
- •Идеал газдың негізгі термодинамикалық процестері, процестердің жұмысы және жылуы, идеал газ күйіндегі заттың калориялық қасиетінің өзгеруін анықтау.
- •Термодинамиканың екінші бастамасы
- •Қайтымды Карно циклі, жылулық пәк
- •Карно теоремасы. Еркін қайтымды цикл, энтропияны күй функциясы ретінде түсіну
- •Еркін қайтымды цикл
- •Қайтымды және қайтымсыз процестердегі энтропияның өзгеруі
- •Оқшауланған термодинамикалық жүйенің тепе-теңдік шарты
- •Күйдің термодинамикалық ықтималдығы
- •Вандер-Ваальс изотермасы және теңдеуі.
- •Нақты заттардың рT-, рv-диаграммасы, күй теңдеуі мен жылулық коэффициенттер және кестелер.
- •Сәулелік ағындардың қасиеті және сәуле бөлетін денелер жүйесінің геометриялық
Жылусыйымдылық түсінігі. Ағындар үшін термодинамиканың бірінші бастамасы. Ағындар жұмысының түрлері.
Дененің күйі шексіз аз шамаға өзгерген кезде денеге dQ мөлшерінде жылу берілсін делік. Осының әсерінен дене температурасы dT ға өзгереді. dQ-дың dT-ға қатынасын дененің осы процестегі жылу сыйымдылығы деп атайды: c=dQ/dT. Таңдап алған өлшемге байланысты жылу сыйымдылық мыналарға бөлінеді:
-1 кг газға жатқызылған меншікті массалық жылусыйымдылық c, Дж/кг·К;
-1 м3 көлемдегі газ мөлшеріне жатқызылған меншікті көлемдік жылу сыйымдылық c’, Дж/м3·К;
-1
кмоль газ мөлшеріне жатқызылған меншікті
мольдік жылу сыйымдылық
 ,
Дж/кмоль·К
,
Дж/кмоль·К
Меншікті
жылу сыйымдылықтардың арасындағы
тәуелділік мына қатынастармен орнатылады:
с=
/ ;
c’=с
;
c’=с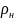
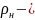 қалыпты
жағдайдағы газ тығыздығы.
қалыпты
жағдайдағы газ тығыздығы.
Термодинамикалық есептеулерде мынадай жылу сыйымдылықтардың маңызы зор:
-Қысым
тұрақты болған кездегі жылу сыйымдылық
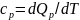
-Көлем
тұрақты болған кездегі жылу сыйымдылық
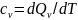
Қозғалыстағы
газдың күйінің өзгеру процесінде
берілген жылу тек қана оның ішкі
энергиясын өзгертіп және сыртқы жұмыс
жасауға жұмсалмай, сонымен бірге оның
арнамен қозғалу кезіндегі сыртқы
кинетикалық энергиясының өсуіне әсер
етеді. Сондықтан термодинамиканың
бірінші заңын былай өрнектеуге болады:
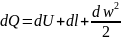 .
.
Егер газ арна бойымен қозғалғанда оның қысымы кеміп жылдамдығы арту арқылы ұлғайса, онда ол арнаны саптама деп атайды.
Егер
арнада газдың қысымы өсіп, жылдамдығы
кему арқылы сығылса, онда ол арнаны
диффузор деп атайды. Итеріп шығару
жұмысын былай өрнектейміз:
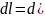 )
)
Сонда
термодинамиканың бірінші заңы
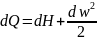
Идеал газдардың термодинамикалық процестері .
Жалпы жағдайда жұмыстық дененің кез келген екі параметрі еркін түрде өзгеруі мүмкін. Бірақ кейбір жеке оқиғалар көбірек ықылас тудырады. Жеке термодинамикалық процестерге жататындар: изохорлы, изобарлы, изотермалы, адиабатты, политропты процесс.
Изохорлы процесс
Көлем тұрақты болғанда өтетін процесс изохорлы процесс деп аталады. Бұл жағдайда V=const. Идеал газ күйінің теңдеуінен PV=RT, V=const болса, онда p/T=R/V=const демек газдың қысымы оның абсолют температурасына тура пропорционал. p2/p1=T2/T1. (Шарль заңы)
Ұлғаю
жұмысы бұл процесте нөлге тең,
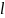 =0.
Сондықтан термодинамиканың бірінші
заңы
=0.
Сондықтан термодинамиканың бірінші
заңы

Изобарлы процесс
Тұрақты
қысымда өтетін процесс изобарлы процесс
деп аталады. Бұл жағдайда p=const. Процесс
сызығы изобара деп аталады. p=const болғанда
V/T=R/V=const болғанда V2/V1=T2/T1. (Гей-Люссак
заңы) Термодинамиканың бірінші заңы
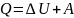
Изотермалы процесс
Изотермалы
процесте температура тұрақты болғандықтан
PV=RT=const, сондықтан p2/p1=V1/V2. Демек газдың
қысымы оның меншікті көлеміне кері
пропорционал (Бойль Мариотт заңы). Бұл
процесте
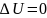 ,
сондықтан термодинамиканың бірінші
заңы
,
сондықтан термодинамиканың бірінші
заңы
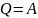 .
.
Адиабатты процесс
Қоршаған
ортамен жылу алмасусыз өтетін процесс
адиабатты процесс деп аталады. Бұл
процесс үшін dQ=0, демек Q=0. Осы аталған
процесті іске асыру үшін газды адиабатты
қабыққа салып жылуоқшаулау керек немесе
газдың қоршаған ортамен жылу алмасуы
үлгермейтіндей етіп процесті өте жылдам
өткізу керек. PVk=const.
Термодинамиканың бірінші заңы
 .
.
Политропты процесс
Политропты
процесс деп PVn=const
теңдеуі арқылы өрнектелетін процессті
айтады. Мұндағы n -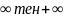 ке дейінгі кез келген мәнге ие болатын,
бірақ берілген процесте тұрақты болатын
санды айтады.
ке дейінгі кез келген мәнге ие болатын,
бірақ берілген процесте тұрақты болатын
санды айтады.
Изохорлы
процесс үшін n=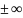
Изобарлы процесс үшін n=0
Изотермалы процесс үшін n=1
Адиабатты процесс үшін n=k
Айналымды прцестер (циклдер). Идеал газ: күй теңдеуі және диаграммалары, негізгі заңдар.
Дөңгелек процесс (цикл).
Дөңгелек процесс немесе цикл деп жүйе бірнеше күйден өтіп барып бастапқы күйге қайта оралу процесін айтады. Циклдің диаграммасы тұйық қисық. Идеал газдың циклін 2 процеске бөлуге болады.
1. Газдың ұлғаюы (1-2);
2. Газдың сығылуы (2-1).
Газ ұлғайған кезде жасалған жұмыс оң dV >0, яғни жұмыс 1а2V2 V11 фигураның ауданына тең болады, ал сығылу жұмысы теріс dV<0 болады да, 2в1V1V22 фигураның ауданымен анықталады. Демек, цикл ішінде газдың жасаған жұмысы тұйық қисықтың ауданымен анықталады.
Идеал газ күйінің тендеуі
Молекулалык-кинетикалық көзқарастар және солардың негізінде алын ған теңдеулер газ кұйін анықтайтын шамаларды өзара байланыстыратын қаты-настарды табуға мүмкіндік береді. Бүл шамаларға газдың р қысымы, оның Т температурасы және газдың белгілі массасын алатын V колем жатады. Оларды күй параметрлері деп атайды.
Бұл
аталған үш шама өзара төуелсіз емес.
Олардың өрбіреуі қалған еке-уінің
функциясы болып табылады. Осы үш
шамаларды - газдың белгілі мас-сасы
үшін оның қысымын, көлемін және
температурасын байланыстырып түратын
тендеуді күй теңдеуі деп атайды және
оны жалпы түрде
![]()
деп жазады.
Идеал газдар үшін күй тендеуін кинетикалық теорияның негізгі (1.4) және (1.5) тендеулерінен жеп-жеңіл алуға болады. Егер
![]()
тендеуге молекула-лардың орташа кинетикалық энергиясының орнына оның
![]()
тендеудегі
мәнін қоятын болсақ, онда:
![]()
Егер V көлемде болшектер саны N болатын болса,
![]()
өрнекке койсақ, мынаған келеміз:
![]()
Ьүл тендеуге барлық үш күй параметрлері де кіреді, сондықтан да ол идеал газ күйінің тендеуі болып табылады.
