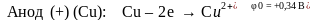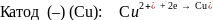- •Электрохимические процессы
- •Возникновение двойного электрического слоя на границе металл – электролит
- •Двойной электрический слой на границе раздела металл - раствор
- •Устройство водородного электрода
- •Гальванический элемент. Электродвижущая сила элемента
- •Элемент Даниэля - Якоби
- •На инертным электроде (платина, графит) протекает электродная реакция: , например, Электродвижущая сила элемента (эдс)
- •Определение направления самопроизвольного протекания окислительно-восстановительной реакции
- •Электролиз. Применение электрохимических процессов
- •Электролиз расплавов и водных растворов
- •Электролиз водного раствора хлорида натрия с инертными электродами
- •Электролиз водного раствора сульфата меди с инертными электродами
- •Электролиз водного раствора сульфата меди с медными электродами
- •Поляризация электродов
- •2. Химическая поляризация связана с изменением химической природы электрода, например, образование оксидной пленки на аноде в результате выделения кислорода при разряде воды;
- •3. Электрохимическая поляризация обусловлена изменением потенциала в результате замедленности электрохимической стадии
- •Законы Фарадея
- •Применение электролиза в технике
Электролиз. Применение электрохимических процессов
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита
При электролизе электрическая энергия превращается в химическую
На аноде протекает процесс окисления, на катоде – процесс восстановления как и в гальваническом элементе:
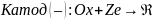
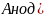
где Ox– окисленная форма вещества; Red – восстановленная форма
Электролиз начинается при определенной разности потенциалов, называемой потенциалом разложения
Первичные процессы при электролизе протекают в пределах двойного электрического слоя (на электродах)
Вторичные процессы – в объеме электролита между продуктами электролиза
Электролиз расплавов и водных растворов
На катоде в первую очередь восстанавливаются более сильные окислители, имеющие более высокие потенциалы
Последовательность катодных процессов:
в первую очередь восстанавливаются катионы металлов, имеющие электродный потенциал положительнее водородного в порядке уменьшения потенциала:
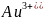 (
(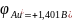 ),
),
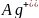 (
(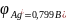 ),
),
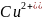 (
(
катионы
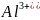 (
(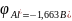 )
и металлов, электродные потенциалы
которых отрицательнее потенциала
алюминия, не восстанавливаются из
водных растворов; в этом случае на
катоде восстанавливаются молекулы
воды
или ионы
)
и металлов, электродные потенциалы
которых отрицательнее потенциала
алюминия, не восстанавливаются из
водных растворов; в этом случае на
катоде восстанавливаются молекулы
воды
или ионы
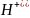 в
кислой среде
в
кислой среде
при электролизе водных растворов солей металлов, электродные потенциалы которых находятся между потенциалами алюминия и водорода, на катоде выделяются совместно как металлы, так и водород
На аноде вначале окисляются более сильные восстановители, имеющие наинизшие электродные потенциалы
Последовательность анодных процессов при использовании инертных электродов (платина, графит и др.):
в первую очередь окисляются анионы бескислородных кислот в порядке возрастания их потенциалов:
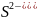 ),
),
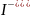
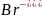 ),
),
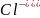 )
)
при электролизе водных растворов, содержащих анионы кислородосодержащих кислот (
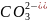 ,
,
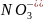 ,
,
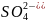 ,
,
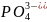 ),
на аноде окисляются молекулы
воды с выделением кислорода
),
на аноде окисляются молекулы
воды с выделением кислорода
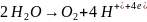 ,
,
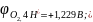
в щелочных растворах окисляются гидроксид-ионы с выделением кислорода
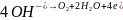 ,
,
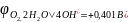
Электролиз расплавов протекает при высоких температурах (порядка 8000С) в электролизерах с инертными электродами
Пример: рассмотрим электролиз расплава хлорида натрия
Схематически процесс можно представить следующей схемой:

Аналогично протекает электролиз расплавов всех галогенидов и гидридов щелочных и щелочноземельных металлов
При электролизе водных растворов необходимо учитывать:
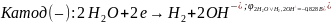
Электролиз водного раствора хлорида натрия с инертными электродами
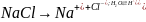
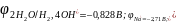
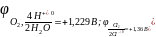
На катоде:
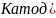 ;
;
На аноде:
Суммарная
реакция:
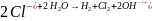
Суммарная реакция, протекающая в электролизере в молекулярной форме:
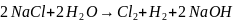
Электролиз водного раствора сульфата меди с инертными электродами
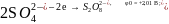
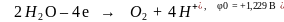
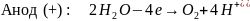
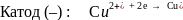
Суммарная реакция:
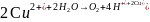
В
молекулярном виде: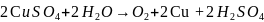
Электролиз водного раствора сульфата меди с медными электродами