
- •Аааааааааааааааааааааааааааааааааааа
- •Ерітінділер. Ерітінділердің концентрацияларын өрнектеу жолдары.
- •1801 Жылы Пруст ашқан Құрам тұрақтылық заңының анықтамасы: * Қандай жолмен алынған болса да, таза химиялық қосылыстың сандық және сапалық құрамдары әрдайым тұрақты болады*.
- •Термодинамиканың іі заңы. Пәк.Энтропия, Гиббс энергиясы.
- •Тотығу-тотықсыздану реакциялары.
- •Химиялық байланыс. Валенттік байланыс әдісі (вбә).Химиялық байланыстың негізгі сипаттамалары. Химиялық байланыстың түзілу механизмі. Химиялық байланыстың бағытталуы
- •Химиялық байланыс түрлері. Гибридтену. Молекулалық орбиталдар әдісі.
- •Химиялық кинетика. Жылдамдықтың концентра-цияға, температураға тәуелділігі. Жылдамдық конс-тантасының физикалық мағанасы.
- •Авагадро заңы. Мольдік көлем. Газдардың салыстырмалы тығыздығы
- •1811 Жылы Авагадро ашқан заң анықтамасы: кез-келген газдың бірдей көлемінде бірдей жағдайда молекулалар саны тең (бірдей) болады.
- •Электролиз.
- •Фарадей заңдары
Термодинамиканың іі заңы. Пәк.Энтропия, Гиббс энергиясы.
Химиялық
реацияның жүруі бір ғана ішкі энергияның
азаюына сай бола бермейтіндігін, басқа
да бір белгісіз фактордың әсеріне
тәуелді екендігі термодинамикалық
функция – Энтропия деп аталады. Жылу
мөлшері Q жүйеге Т температурада қайтымды
процесс арқылы сіңірілсе, жүйенің
энтропиясы S мына шамаға тең болады:
𝛥S=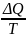 . Энтропияның өлшемі ретінде шартты
нэнтропиялық бірлік (э.б) пайдаланылады,
э.б= 4,1840 кДж\моль*К
. Энтропияның өлшемі ретінде шартты
нэнтропиялық бірлік (э.б) пайдаланылады,
э.б= 4,1840 кДж\моль*К
Термодинамиканың екінші заңының математикалық өрнегі былай жазылады:
dS ≥ δQ/T ; ΔS ≥ Q/T
Гиббс (G) және Гельмгольц (А) энергиялары жүйенің термодинамикалық күй функциялары болып табылады – олар жүйенің сыртқы ортаға беретін энергия бөлігімен сипатталады. Сондықтан да оларды «еркін» энергиялар деп атайды. Жүйенің ішкі энергиясының қалған бөлігі жұмысқа ауыса алмайды, жүйеде қалып қояды және сол себептен «байланысқан» энергия деп аталады.
Байланысқан энергия жүйенің энтропиясымен анықталады және ол абсолюттік температураны энтропия өзгерісіне көбейткенге тең, яғни TdS немесе TΔS:
dG ≤ dH − TdS ; ΔG ≤ ΔH – TΔS
Тотығу-тотықсыздану реакциялары.
Тотығу-тотықсыздандыру процесінің осы күнгі теориясын жасаған Ресей ғалымдары – Писаржевский, Михайленко , Беркенгейм, Даин. Ол теорияның негізгі қағидалары мыналар:
1) Тотығу дейтініміз, атомның, молекуланың, ионның электрон беру процесі. Мыс:
а)атом
электронын берсе, оң зарядты ионға:
Cl-7é→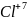 айналады
айналады
б)
теріс зарядты ион электрон б)ерсе:
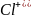 -é→Cl
, бейтарап
-é→Cl
, бейтарап
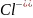 -2é→
,оң зарядты ионға айналады
-2é→
,оң зарядты ионға айналады
в)оң
зарядты ион электрон берсе, оның оң
зарядты берген электрон санына сәйкес
өседі:
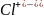 4é=
4é=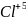
2) Тотықсыздану дейтініміз атомның, молекуланың, немесе ионның элетрон қосып алу процессі. Мыс:
А) атом электрон қосып алса, теріс зарядты ионға айналады Cl+e=
Б) оң зарядты ион элетрон қосып алса :
+4é→ заряд саны кеміген оң зарядты ионға
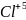 +
5
+
5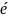 →
Cl Бейтарап
атомға
→
Cl Бейтарап
атомға
+6é→ теріс зарядты ионға айналады
3) Тотықтырғыш – электрон қосып алушы бөлшек (бейтарап атом ,молекула, ион)
4) Тотықсыздандырғыш- электрон беруші бөлшек (бейтарап атом, молекула, не ион)
Д.И.Менделеев кестесіндегі орнына байланысты элементтердiң тотығу дәрежелерi ең төменгi (-4) дәрежесiнен 8-ге тең дәреже арқылы ең жоғарғы дәрежесiне (+8) дейiн өзгередi. Мысалы:
C-4 N-3 S-2 Cl- H0 K+ Mn+2 Cr+3 Mn+4 N+5 S+6 Mn+7 Os+8
СН4, NH3, H2S, HCl, H2, KCl, MnSO4, Cr2O3, MnO2, HNO3, H2SO4, HMnO4, OsO4.
Менделеев кестесіндегі I, II және III топ элементтерiнiң ион түрiнде тотығу дәрежелерi тұрақты, яғни өзгермейдi. Мысалы: – Н+, Са+2, Аl+3. Барлық басқа топ элементтерiнiң тотығу дәрежелерi тұрақсыз және бiр элементтiң өзi бiрнеше тотығу дәрежелерiн көрсетуi мүмкiн. Мысалы, марганецтi Mn алайық, оның электрондық формуласы мынадай: 25Mn 1S22S2p63S2p64S23d5. Валенттiлiк электрондары 4S23d5.
Тотығу-тотықсыздану реакциясы үш ортада қышқылдық, бейтарап және сiлтiлiк ортада жүруi мүмкiн.
Тотығу-тотықсыздану нәтижесiнде түзiлетiн заттарды дұрыс жазу үшiн элементтер мен күрделi заттардың химиялық қасиеттерiн және кейбiр ережелердi жақсы бiлу керек.
ХХХХХХХХХХХХХХХХ
Химияның негізгі түсініктері мен заңдары. Авогадро заңы.
Химияның негізгі түсініктері: атом, молекула, химиялық элемент, салыстырмалы атомдық және молекулалық массалар, моль, молярлық масса, эквивалент.
Авагадро тұрақтысы
СИ –жүйесінде моль зат мөлшерінің өлшем бірлігі, белгіленуі ν(Са)=1,2 моль.
Моль дегеніміз – көміртегі изотобында 12г қанша атом болса, сонша құрылымдық бөлшектер (молекула, атом, иондар) болатын заттың мөлшері. 12г-да 6,02∙1023 құрылымдық бөлшектер болатыны анықталған.
Авагадро тұрақтысы деген осы шама:
Молярлық масса заттың молінің массасы, өлшем бірлігі г/моль.
M(КOH)=56 г/моль.
Заттың
мөлшерімен молярлық массасы массамен
төмендегідей қатынаста болады:
V=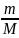 немесе m=VM
немесе m=VM
