
- •«Окислительно-восстановительные реакции» Степень окисления атома элемента
- •Восстановители
- •Окислители
- •Основные типы окислительно-восстановительных реакций
- •Составление уравнений окислительно-восстановительных реакций
- •Метод электронного баланса
- •Влияние среды на характер реакций
- •Метод полуреакций (электронно-ионный метод)
Влияние среды на характер реакций
Протекание окислительно-восстановительной реакции зависит от реакции среды. Для создания в растворе кислой среды чаще всего пользуются серной кислотой, для создания щелочной среды служит обычно NaOH или КОН. Вещество, при помощи которого создается среда не всегда входит в окончательное уравнение реакции. В зависимости от среды может меняться и характер протекания процесса между одними и теми же реагентами. Известно, например, что перманганат калия в зависимости от характера среды может восстанавливаться до различных продуктов:
+7
MnO4 Mn2+ (в кислой среде),
+7 +4
MnO4 MnО2 (в нейтральной или слабощелочной среде),
+7 +6
MnO4 MnО42 (в сильнощелочной среде).
Из этих схем видно, что наибольшую окислительную активность ион MnO4 проявляет в кислой среде, меньшую – в нейтральной и слабощелочной и минимальную – в сильнощелочной.
Метод полуреакций (электронно-ионный метод)
По этому методу для удобства окисление и восстановление необходимо рассматривать как самостоятельные процессы, каждый из которых отражает половину полного уравнения реакции. Отсюда и название «полуреакция».
Для примера рассмотрим реакцию, которая протекает при взаимодействии перманганата калия с нитритом калия в кислой среде. Процесс уравнивания уравнений окислительно-восстановительных реакций электронно-ионным методом включает следующие шаги:
1. Составим полную ионную схему реакции. При этом сильные электролиты записывают в виде ионов, а слабые электролиты, осадки и газы в виде молекул:
КMnO4 + KNO2 + H2SO4 MnSO4 + KNO3 + K2SO4 + H2O
K++MnO4- +K+ +NO2- +2H+ + SO42- Mn2+ +SO42- + K+ + NO3- + 2K+ + SO42- + H2O
2. Составим сокращенную ионную схему реакции, в которой указывают только те ионы, которые реально участвуют в окислении и восстановлении. Определяют окислитель и восстановитель:
MnO4- + NO2- + H+ Mn2+ + NO3- + H2O
окислитель восстановитель
3. Составим электронно-ионное уравнение для каждой полуреакции. При этом руководствуются следующими правилами:
а) избыточный кислород в кислой среде связывается ионами водорода с образованием молекулы воды;
б) избыточный кислород в нейтральной или щелочной среде взаимодействует с водой с образованием удвоенного числа гидроксильных групп.
Первая полуреакция:
MnO4- Mn2+
Избыточный в левой части уравнения кислород следует связать ионами водорода, так как реакция протекает в кислой среде:
MnO4- + 8Н+ Mn2+ + 4 H2O
Далее необходимо выполнить закон электронейтральности – суммарное число зарядов продуктов реакции должно быть равно суммарному числу зарядов исходных веществ.
Сумма зарядов продуктов реакции равна 2+ ( заряд иона марганца Mn2+). Этому же количеству зарядов должна быть равна и сумма зарядов исходных веществ, т. е. слева в уравнение нужно прибавить 5ē:
MnO4- + 8Н+ + 5ē Mn2+ + 4 H2O
Вторая полуреакция:
NO2- NO3-
Избыточный в правой части уравнения кислород необходимо связать ионами водорода. При этом для сохранения баланса вещества в левой части уравнения следует подставить одну молекулу воды:
NO2- + H2O NO3- + 2Н+
При соблюдении равенства зарядов правой и левой частей уравнения схема принимает следующий вид:
NO2- + H2O - 2ē NO3- + 2Н+
4. Уравниваем числа электронов, участвующих в полуреакциях. Для этого уравнение каждой полуреакции умножают на такой множитель, чтобы число электронов, участвующих в процессе восстановления было равно числу электронов, участвующих в процессе окисления. Уравнения полуреакции суммируют и получают полное ионное уравнение реакции:

MnO4- + 8Н+ + 5 ē Mn2+ + 4 H2O 2
NO2- + H2O - 2 ē NO3- + 2Н+ 5

2 MnO4- + 16Н+ + 10 ē + 5NO2- + 5H2O - 10 ē 2Mn2+ + 8H2O + 5NO3- +10Н+
5. Произведём возможные упрощения (приведение подобных членов):
2 MnO4- + 6Н+ + 5 NO2- 2Mn2+ + 3H2O + 5NO3-
6. Составим уравнение в молекулярном виде. Для этого нужно приписать в правую и левую части уравнения недостающие ионы в одинаковом числе:
2КMnO4 + 5KNO2 + H2SO4 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
Метод полуреакций более универсален и имеет несомненные преимущества по сравнению с методом электронного баланса при составлении уравнений реакций с участием, в частности, органических соединений, пероксида водорода, некоторых соединений серы и т. д.
Рассмотрим, например, процесс окисления этилена, происходящий при пропускании его через раствор перманганата калия в слабощелочной среде:
1. Перманганат калия восстанавливается до оксида марганца (IV):
MnO4 MnO2
MnO4 + 2Н2О MnO2 + 4ОН
MnO4 + 2Н2О + 3ē MnO2 + 4ОН
2. Этилен под действием водного раствора КMnO4 окисляется с образованием этиленгликоля ОНСН2СН2ОН:
С2Н4 С2Н6О2
С2Н4 + 2ОН С2Н6О2
С2Н4 + 2ОН - 2ē С2Н6О2
3. Умножая уравнения полуреакций окисления и восстановления на соответствующие коэффициенты и складывая, получим полное ионное уравнение окислительно-восстановительной реакции:
MnO4 + 2Н2О + 3ē MnO2 + 4ОН 2
С2Н4 + 2ОН - 2ē С2Н6О2 3
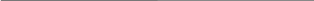 2MnO4
+ 4Н2О
+ 3С2Н4
+ 6ОН
2MnO2
+ 8ОН
+ 3С2Н6О2
2MnO4
+ 4Н2О
+ 3С2Н4
+ 6ОН
2MnO2
+ 8ОН
+ 3С2Н6О2
4. Производим необходимые сокращения:
2MnO4 + 4Н2О + 3С2Н4 2MnO2 + 3С2Н6О2 + 2ОН
5. Записываем уравнение в молекулярном виде:
2КMnO4 + 3С2Н4 + 4Н2О 2MnO2 + 3С2Н6О2 + 2КОН
