
ММ Материаловедение / _1-тема-СтрМетал
.docЛитература: 1. Лившиц Б.Г. Металлография. М.: Металлургия, 1971 или 1990.
2. Лахтин Ю.М. Металловедение и термическая обработка металлов. М.: Металлургия, 1984. 360 с.
3. Научные основы материаловедения./ Под ред. Б.Н.Арзамасова. М.: Изд-во МГТУ им. Н.Э.Баумана. 1994, 366 с.
Введение
Металлография - это наука о структуре металлов и сплавов. Она является основой металловедения, в котором рассматриваются теория и практика легирования, зависимости эксплуатационных и технологических свойств от структуры и состава металлов и сплавов, применяющихся на практике.
Элементарные сведения о металлов и сплавах накапливались веками, однако до 18 века были очень скудны. В 60-х годах 18 века русский ученый Ломоносов М.В. попытался дать определение, что такое металл. По его определению металлом называется «светлое тело, которое ковать можно». Т.о., Ломоносов положил в основу определения понятия металла высокую отражательную способность металлических тел, или их блеск, и высокую пластичность.
Ломоносов сделал и второе важное открытие. Он подметил кристалличность самородных металлов (меди и золота) и отметил сходство металлических кристаллов и солей. Понятие о кристалличности в дальнейшем легло в основу современного научного объяснения пластических и прочностных характеристик металлов.
Бурное развитие науки о металлах началось в 19 веке. Основоположниками современного металловедения явились российские заводские инженеры П.П.Аносов (1799-1851) и Д.К.Чернов (1839-1921).
Великий русский металлург Павел Петрович Аносов на Златоустовском заводе впервые (в 1831 г.) применил микроскоп для исследования структуры металлов. При этом он применил химическое травление полированной поверхности металла (шлиф). Лишь через 30 лет этот же метод исследования был применен английским ученым Сорби. Аносову принадлежит приоритет в создании легированных сталей. Он разработал теорию и технологию изготовления клинков из булатной стали. Из его работ стало ясно, что так называемый булатный узор на поверхности стали непосредственно зависит от ее внутренней структуры.
Велико значение работ Дмитрия Константиновича Чернова, всемирно признанного отца металлографии.
В 1868 г. Д.К.Чернов впервые указал на превращения в твердой стали при определенных температурах, сопровождающиеся тепловыми эффектами. В дальнейшем Д.К.Чернов высказал предположение, что эти превращения аллотропические, что впоследствии было подтверждено рентгеноструктурным анализом. Изображенная графически зависимость температуры этих превращений и плавления стали от содержания в ней углерода, которая была найдена Д. К. Черновым по цветам каления, явилась прототипом диаграммы равновесия Fе - С. Однако идеи о фазовом равновесии появились позднее, после работ Гиббса и ученых голландской школы.
Своим открытием аллотропических превращений в стали Д.К.Чернов заложил прочный фундамент теории термической обработки стали. Критические точки в стали, найденные им, позволили рационально выбирать температуру ее закалки, отпуска и пластической деформации в производственных условиях. Он указал также на значение времени выдерживания стали при той или иной температуре, заложив тем самым основы изучения кинетики фазовых превращений и формирования структуры.
В 1873 -- 1876 гг. Гиббс изложил основные законы фазового равновесия и, в частности, правило фаз, основываясь на законах термодинамики. Из законов Гиббса о минимуме термодинамического потенциала можно вывести все типовые диаграммы равновесия, не прибегая дополнительно ни к каким другим допущениям.
В начале 20 века большую роль в развитии металловедения сыграли работы Курнакова Н.С., применившего для исследования металлов методы физико-химического анализа (электрические, дилатометрические, магнитные и др.).
Определение атомного строения фаз стало возможным после открытия Лауэ (1912 г.), показавшего, что атомы в кристалле регулярно заполняют пространство, образуя пространственную дифракционную решетку, и что рентгеновские лучи имеют волновую природу. Дифракция рентгеновских лучей на такой решетке дает возможность исследовать строение кристаллов. В последнее время для структурного анализа, кроме рентгеновских лучей, используют электроны и нейтроны, которые также дают дифракционный спектр при прохождении через кристалл. Соответствующие методы исследования называются электронографией и нейтронографией. Электронная оптика позволила усовершенствовать микроскопию. В настоящее время на электронных микроскопах полезное увеличение доведено до 100 000, в то время как
на обычных световых микроскопах оно не превышает 2000.
Весьма большое значение в развитии металловедения сыграли работы Курдюмова Г.В., Садовского В. Д., Конобеевского С.Т. и др.
Основные свойства металлов. Особенности строения атомов простых и переходных металлов.
Среди известных 106 элементов, металлов -- подавляющее большинство, 76. Такие элементы как Si, Ge, As, Se, Te являются переходными между металлами и неметаллами.
Металлы в твердом состоянии и отчасти в жидком обладают рядом характерных свойств:
- высокой тепло- и электропроводностью
- положительным температурным коэффициентом электросопротивления, с повышением температуры электросопротивление чистых металлов возрастает. Около 30 металлов обладают сверхпроводимостью, т.е. их электросопротивление скачкообразно падает до 0 при температурах вблизи 0К.
- термоэлектронной эмиссией, т.е. способностью испускать электроны при нагреве,
- хорошей отражательной способностью, металлы непрозрачны и обладают металлическим блеском,
- повышенной способностью к пластической деформации.
Атомы металлов легко расстаются со своими валентными, наиболее удаленными от ядра электронами, в то время как неметаллы прочно их удерживают. Ионизационный потенциал у металлоидов более высокий [1,6 х 10-6 кдж (10 эв) и выше (за исключением бора - 8 эв), чем у металлов, ионизационный потенциал которых в подавляющем числе случаев равен 6,4 -- 14,5 х10-7 кдж (4 - 9 эв). Ионизационный потенциал полупроводников С, Si, Ge, Аs, Sе,Те, -Sn составляет 1,3 - 1,6 х 10-6 кдж (8 -- 10 эв).
Кристалл типичного металла можно рассматривать как коллектив положительных ионов, находящихся в среде свободных электронов. Взаимодействие между положительными ионами и коллективизированными электронами является основным фактором, определяющим так называемую металлическую связь. Она не имеет направленного характера. Ионы сохраняют постоянное положение (если пренебречь самодиффузией и тепловыми колебаниями) и образуют пространственную решетку кристалла, в то время как электроны металла не фиксированы в определенных местах. Они заполняют все промежутки между ионами и отчасти проникают в их внутренние зоны.
Сила притяжения
Сила отталкивания
Ro +F -F







Т.о., при закономерном расположении атомов в металле с образованием правильной кристаллической решетки будет реализовано состояние с минимальной энергией взаимодействия атомов.
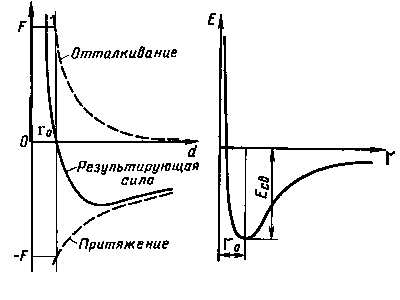
Т.о., при закономерном расположении атомов в металле будет реализовано состояние с минимальной энергией взаимодействия атомов.
Для описания атомно-кристаллической структуры пользуются понятием пространственной или кристаллической решетки.
Кристаллическая решетка представляет собой воображаемую пространственную сетку, в узлах которой располагаются атомы (ионы), образующие твердое кристаллическое тело. (Рис.). Наименьший объем кристалла, дающий представление об атомной структуре металла во всем объеме, получил название элементарной кристаллической решетки.

|
Сингония |
Соотношения между осями |
Углы между осями |
Возможные типа кристалл. Решеток |
|
Кубическая |
a = b = c |
= = = 90o |
Примитивная, объемноцентрированная и гранецентри-рованная |
|
Гексагональная |
a = b c |
= = 90o = 120o |
Примитивная |
|
Тетрагональная |
a = b c |
= = = 90o |
Примитивная и объемноцентрированная |
|
Ромбоэдрическая (тригональная) |
a = b = c |
= = 90o |
Примитивная |
|
Ромбическая (Fe3C) (орторомбическая) |
a b c |
= = = 90o |
Примитивная, базо-центрированная, объемноцентрированная и гранецен-трированная |
|
Моноклинная |
a b c |
= = 90o 90o |
Примитивная, базоцентрированная |
|
Триклинная |
a b c |
90o |
Примитивная |
Подавляющее число технически важных металлов образуют одну из следующих высокосимметричных решеток с плотной упаковкой атомов (Рис.): кубическую объемноцентрированную (ОЦК), кубическую гранецентрированную (ГЦК) и гексагональную (ГП) (Рис.)

ОЦК металлы - W, Mo, Cr, V, Ka, Na, Li, -Ti, -Fe, Ta и др.
ГЦК металлы - Al, Cu, Ni, Ag, Au, Pb, -Fe, Pd, Ir Ce и др.
ГП металлы - Mg, Zn, -Ti, Cd, Be, -Zr, Os и др.
На одну элементарную ячейку ОЦК решетки приходится 2 атома (1 - в центре куба и 1/8 x 8 = 1 вершинные атомы), ГЦК - 4 атома ( 1/8 х 8 = 1 - вершинные и 1/2 х 6 = 3 атомы граней, ГП - 6 атома (3 + 1/6 х 12 + 1/2 x 2 =6).
Плотность кристаллической решетки (объем занятый атомами) характеризуется координационным числом, т.е. числом ближайших соседних атомов, окружающих данный атом. Чем выше координационное число - тем больше плотность упаковки атомов.
В ОЦК решетке - наименьшее расстояние d = 0,5a3. На этом расстоянии находятся 8 атомов. К=8. Коэффициент заполнения = 0,68. ГЦК - наименьшее расстояние d = 0,5a2. К=12. Коэффициент заполнения = 0,74. ГП - наибольшая плотность при с/ a=1,633, К=12, Коэффициент заполнения = 0,74.
Индексы Миллера используются как универсальная система обозначения граней кристалла или плоскостей его пространственной решетки. Чтобы определить индексы для данной плоскости нужно:
1. Найти точки пересечения данной плоскости со всеми тремя осями координат в кристалле (в масштабе соответствующих трансляций).
2. Взять обратную величину от найденных чисел.
3. Привести индексы к наименьшим целочисленным значениям, сохраняя при этом их соотношение.
4. Заключить индексы в круглые скобки (hkl).
(hkl) - -одна или группа параллельных плоскостей, {hkl} - полный набор эквивалентных плоскостей.
Например для ОЦК решетки плоскости куба пересекает отрезки (1 ) ( 1 ) ( 1). Обратные величины (100) (010) (001). Индексы могут быть и с минусами. Совокупность плоскостей обозначаются фигурными скобками. Например {100}. Для ГП решетки пользуются индексами Миллера-Браве (hkil), где i= - (h+k).
Кристаллографические направления обозначаются индексами [u v w], где u v w - простые числа, пропорциональны координатам выбранного узла вдоль осей X Y Z, который лежит на прямой, проходящей через начало координат, выраженных в осевых единицах.
Как видно из рассмотренных типов кристаллических решеток плотность расположения атомов по различным плоскостям неодинакова. Наиболее плотноупакованными плоскостями для ОЦК решетки является (110), для ГЦК (111) и для ГП решетки (001). Вследствие неодинаковой плотности атомов в различных плоскостях многие физические и механические свойства зависят от направления вырезки образцов. Подобная неодинаковость свойств по различным кристаллографическим направлениям называется анизотропией. Анизотропия является важнейшим свойством кристалла. Например, для монокристалла чистой Сu (ГЦК) предел прочности в направлении [100] составляет 146 МН/м2, а в направлении [110] - 350 МН/м2.
Очень многие металлы используются в поликристаллическом виде, где обычно кристаллы расположены беспорядочно и макроскопические свойства в различных направлениях одинаковы, т.е. квазиизотропны. Однако иногда необходимо получение анизотропных свойств, тогда в материале создают преимущественную ориентировку кристаллографических плоскостей, которая называется текстурой.
