
- •Материаловедение
- •Железо
- •При нормальных условиях Fe существует в двух аллотропических модификациях.
- •Впервые критические температуры превращений железа были определены в 1868 г. Д.К. Черновым. В
- •Механические свойства.
- •Углерод
- •В обычных условиях С находится в виде графита с гексагональной слоистой решеткой. Между
- •Основными фазами в сплавах системы «железо – углерод» являются:
- •Твердые растворы углерода в полиморфных - и -модификациях железа являются растворами внедрения.
- •Твердый раствор углерода в -Fe (решетка ГЦК) называют аустенитом. Максимальная растворимость углерода в
- •Цементит – карбид железа Fe3C, образующийся
- •Графит, образующийся в железоуглеродистых сплавах, мало отличается от природного графита и представляет собой
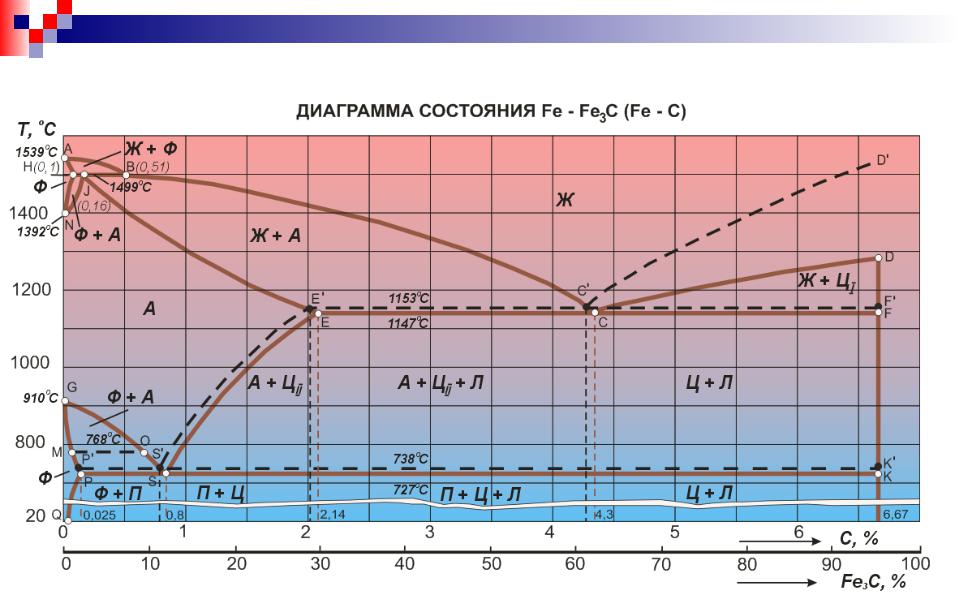
- •На диаграмме равновесия Fe – С имеются следующие линии:
- •В области затвердевших сплавов
- •Положение особенных точек диаграммы
- •Переход к следующей теме

Материаловедение
Диаграмма состояния Fe – C
1
Железо
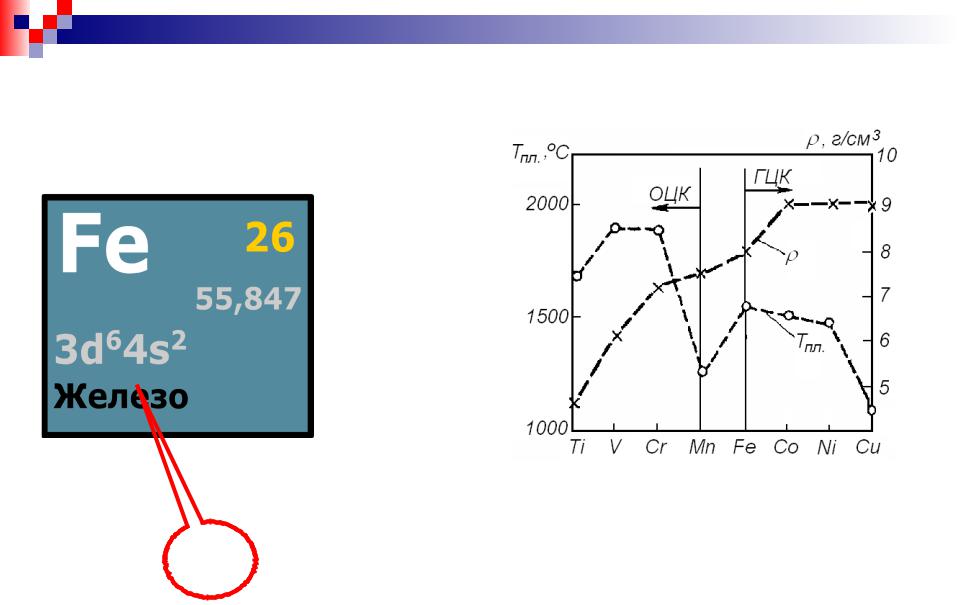
Fe (атомный номер 26; атомный вес 55,85) – ферромагнитный металл серебристо-белого цвета. Плотность – 7,86 г/см3. Тпл. = 1539 °С.
Переходный металл.
|
Атом Fe располагается в конце первой группы |
||||
|
переходных металлов. Соседние элементы с |
||||
|
большими |
атомными номерами |
(Со, Ni, Сu) |
||
1s2 2s2p6 3s2p6d6 4s2 |
кристаллизуются в плотноупакован-ные структуры, |
||||
|
пока |
их |
3d-состояния |
не |
оказываются |
|
заполненными в меди. Переходные элементы с |
||||
|
менее заполненными 3d-состояниями ( -Ti, V, Cr, |
||||
|
-Мn) имеют о.ц.к. структуру. Fe находится между |
||||
|
этими группами. |
|
2 |
||
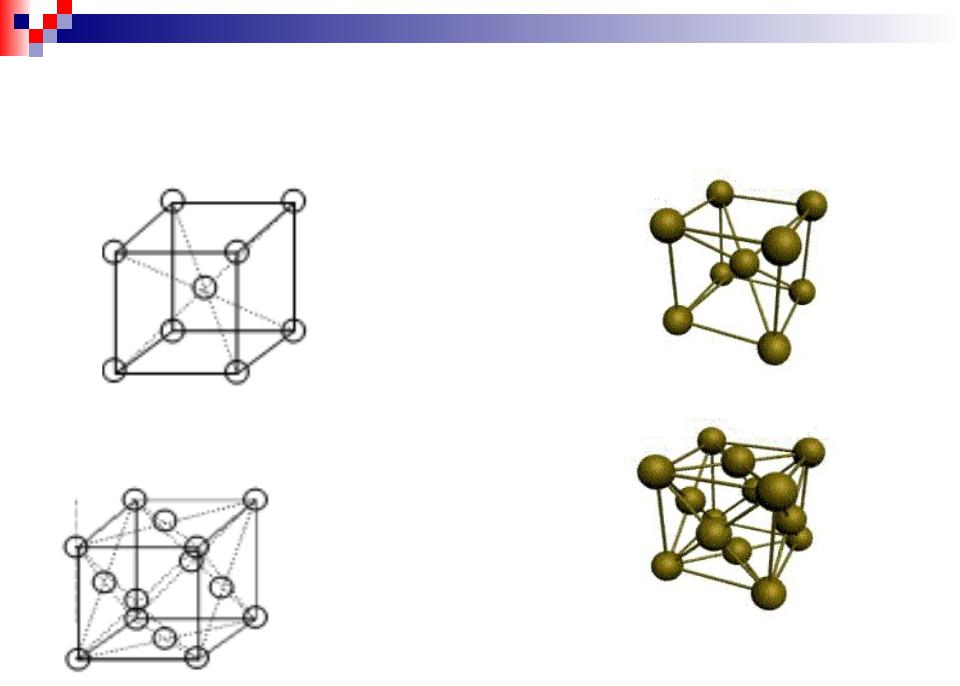
При нормальных условиях Fe существует в двух аллотропических модификациях.
Кристаллическое строение.
(δ)-Fe – ОЦК решетка (а = 0,286 нм)
-Fe – ГЦК решетка (а = 0, 364 нм) |
3 |

Впервые критические температуры превращений железа были определены в 1868 г. Д.К. Черновым. В 1888 г. французский ученый Осмонд предложил каждую критическую точку обозначить индексом А (от французской “arret” – что означает остановку на термической кривой). Для различия критических точек при нагревании и охлаждении к обозначению критической точки А добавляется индекс “с” (от французского слова choftage – нагревание) или индекс “r” (от французского refroidissement – охлаждение).
Критические точки температур превращений (след. слайд)
4
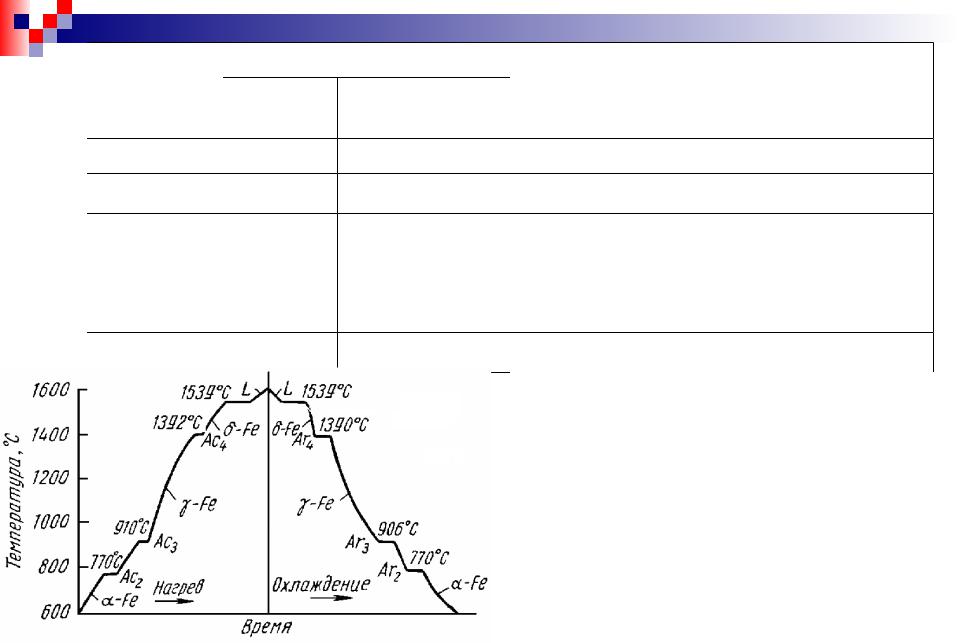
Тем-ра |
Обозначения критич. точек |
|
превр., °С |
при нагр. |
при охлажд. |
|
||
1539 |
– |
– |
1392 |
Ас4 |
Аr4 |
910 |
Ас3 |
Аr3 |
770 |
A2 |
A2 |
727 |
Ас1 |
Ar1 |
210 |
Ао |
|
Примечание
 Плавление, кристаллизация
Плавление, кристаллизация
Fe ) Fe
 Fe Fe
Fe Fe
Магнитное превращение железа Эвтектоидное превращение цементита
НижеМагнитное910 ипревращениевыше 1401°Сцементитадо Т (1539°С)
пл.
стабильно -железо (Fe ) с о.ц.к. решеткой.
Модификацию -железа, стабильную выше 1401°С, обозначают как Fe . Fе и Fе - это одна и та же модификация железа.
Между 910 и 1401°С - -железо (Fe ) c г.ц.к. решеткой.
В отличие от ферромагнитного -железа парамагнитное -железо обозначают как -железо (Fe ). При превращении в точке Кюри A2 кристаллическая решетка не
меняется, этот переход имеет электронную природу.
-железо является неферромагнитной.5

Механические свойства.
Технически чистое железо содержит небольшие количества примесей, попадающих в него из руды или из топлива и воздуха при выплавке:
С, Mn, Si, Al, S, Р, О, N, Н, Сu, Cr, Ni.
Твердость технически чистого железа, содержащего 99,9%Fe, значительно выше чем у химически чистого; HB ~ 900 МПа (У химического чистого железа – HB ~ 490 МПа).
Механические свойства: в = 300…350 МПа, = 35…40%, = 65…70%.
6

Углерод
Углерод – нeметаллический элемент IV группы II периода, порядковый номер 6, атомная масса 12,01; плотность 2,5 г/см3, температура плавления ~3500°С. Он растворяется в довольно значительных количествах не только в жидком железе, но и в -Fe и -Fe.
Предельная растворимость в -Fe при 20°С - 0,006%, при 725°С - 0,025%. В -Fe - 0,8% при 727°С и 2,14% при 1147°С.
Углерод, как и железо, обладает полиморфизмом.
7
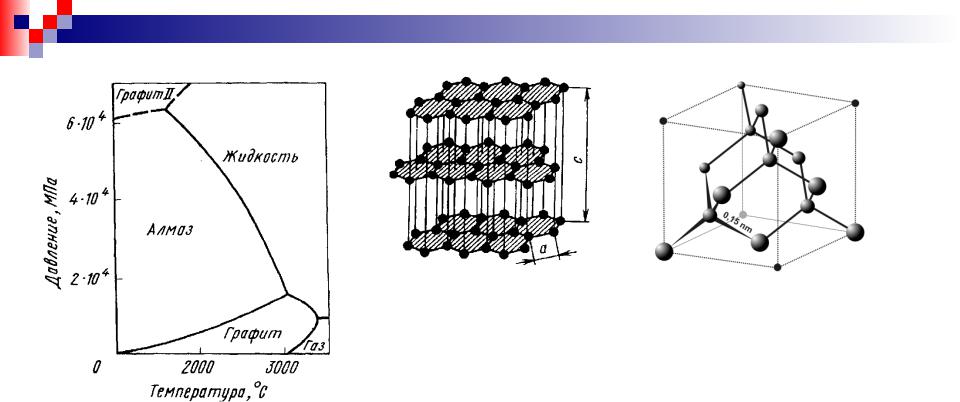
В обычных условиях С находится в виде графита с гексагональной слоистой решеткой. Между атомами углерода каждого слоя действуют сильные ковалентные связи (энергия связи ~680 Дж/кмоль), так как межатомные расстояния здесь очень малы (0,1415 нм).
Ковалентные связи осуществляются спариванием трехвалентных электронов каждого
атома с электронами трех окружающих его соседей. Четвертые валентные электроны переходят в коллективные, и это сообщает графиту металлические свойства, в первую
очередь, повышенную электрическую проводимость, Слои находятся на сравнительно
больших расстояниях друг от друга (0,3354 нм) и связаны поляризационными силами. Алмаз характеризуется тетраэдрической решеткой, в которой каждый атом углерода
ковалентно связан с четырьмя соседями, находящимися на расстоянии 0,1545 нм. Алмаз при обычных T и P в сплавах Fe–C не встречается.
8

Модификация углерода в виде алмаза в обычных условиях метастабильна. Высокое давление (>1000 МПа) стабилизирует
модификацию углерода в виде алмаза. При давлениях свыше 60000 МПа стабилен графит II, имеющий о.ц.к. решетку.
Переход алмаза в графит возможен при температурах ~1200°С.
9
10
