ММ Материаловедение / _3 тема - Кристаллизация металлов
.docx
Кристаллизация металлов.
В газах и жидкостях отсутствует закономерность в расположении частиц. Твердые кристаллические тела характеризуются правильным расположением атомов в узлах кристаллической решетки (ближний порядок), а отдельные блоки и ячейки определенным образом ориентированы по отношению друг к другу (дальний порядок).
Кристаллизацией называется процесс перехода металла из жидкого состояния в твердое.
Кристаллизация является основным фазовым превращением, происходящим во всех металлах, так как при этом формируется кристаллическая структура, характерная для твердого тела. Изучение процесса кристаллизации имеет важнейшее значение для материаловедения, поскольку законы кристаллизации в принципе справедливы практически для всех превращений, в том числе и для превращений, происходящих в металлах и сплавах в твердом состоянии.
Для понимания процесса кристаллизации надо, прежде всего, рассмотреть строение жидкого металла, в котором при соответствующих условиях формируются кристаллы.
Структура жидких металлов. По современным данным, основанным на изучения физических свойств и структур жидких металлов, установлено, что металл в этом состоянии по своему строению значительно ближе к твердому телу, чем к газообразному. Например, теплоемкость жидкого металла лишь на 10% выше теплоемкости твердого металла, тогда как различие по величине этого же свойства между жидким металлом и находящимся в газообразном состоянии составляет 25—30% и более.
В жидкости наблюдается тенденция к правильному расположению атомов. Каждый атом окружен некоторым числом атомов-соседей. Однако из-за интенсивного теплового движения атомов такое соседство постоянно нарушается и вновь возникает. Тем не менее вблизи температуры кристаллизации образуются группы атомов, имеющие такую же структуру, как и в кристалле. Описанная ситуация в жидком металле называют наличием ближнего порядка. Ближний порядок не вызывает анизотропии, т.е. свойства жидкого металла изотропны. Межатомные расстояния при плавлении почти всех металлов, имеющих компактные решетки, увеличиваются и их объем возрастает на 2-6%. Металлы и неметаллы с явно выраженной ковалентной связью, имеющие некомпактную решетку (Si, Bi, Ge), при плавлении сжимаются.
Процесс кристаллизации. Рассмотрим переход жидкость твердое тело при следующих допущениях:
а) энергия на границе раздела изотропна - не зависит от того, какая грань кристалла развивается при его росте;
б) отсутствует теплообмен между кристаллизующейся системой и внешней средой.
Рассмотрим
схематически кривые охлаждения при
затвердевании аморфного и кристаллического
тел. Если бы агрегатное состояние не
изменялось (аморфное состояние), то
зависимость температуры от времени
была бы выражена плавной кривой (Рис.,
а). 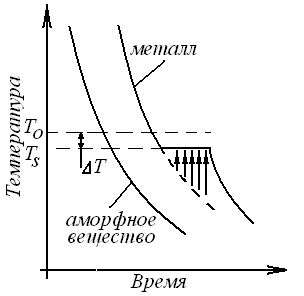
Жидкий металл обладает большей внутренней энергией, чем твердый, поэтому при кристаллизации выделяется теплота. Когда кристаллизуется чистый элемент, отвод теплоты, происходящий вследствие охлаждения, компенсируется теплотой кристаллизации. Поэтому на кривой охлаждения в координатах «температура – время» процессу кристаллизации соответствует горизонтальный участок. Наличие остановки при Тs на кривой показывает, что затвердевание происходит в изотермических условиях.
Температура Тo, при которой жидкость находится в термодинамическом равновесии с твердой фазой, при любой скорости затвердевания выше Тs. Разница Тo-Тs=Т называется величиной переохлаждения и зависит от условий охлаждения, чистоты металла и многих других факторов. В частности, чем быстрее охлаждение, тем больше Т.
При
медленном охлаждении, соответствующем
кривой v1, степень переохлаждения невелика
и кристаллизация протекает при
температуре, близкой к равновесной. С
ростом скорости охлаждения (v2, v3) степень
переохлаждения растет, и процесс
кристаллизации протекает при все более
понижающейся температуре.
В общем, величина степени реально достигаемого переохлаждения или перегрева зависит от природы металла. Она увеличивается с повышением его чистоты и скорости охлаждения. В обычных производственных условиях степень переохлаждения металлов при кристаллизации колеблется от 10 до 30°С; при больших скоростях охлаждения она может достигать сотен градусов. Чем больше скорость охлаждения, тем ниже температура, до которой может быть переохлажден жидкий металл до конца кристаллизации. Это положение приобрело в последние годы не только теоретическое, но и большое практическое значение. Оказалось, что при очень больших скоростях охлаждения (107-109 оС/с) жидкий металл может быть переохлажден до нормальной температуры без его кристаллизации. В результате металл оказывается в аморфном, или стеклообразном состоянии.
Металл в таком состоянии при существующей технике может быть получен лишь в виде очень тонких лент, проволоки, мельчайших капель (гранул), чешуек и т.д. Существенно, что и в таком состоянии металл находит важное техническое использование из-за необыкновенных свойств, которые недостижимы для металла кристаллического строения. Структура такого металла можно представить как плотную хаотическую упаковку твердых шаров. Естественно, что металл со структурой переохлажденной жидкости, т.е. в аморфном состоянии является термодинамически неустойчивым по отношению к кристаллическому состоянию, так как его объемная свободная энергия выше. Поэтому при последующем нагреве, когда атомы приобретают определенную подвижность, в таком аморфном или стеклообразном металле (металлические стекла) будет происходить процесс кристаллизации.
В последние годы нашли широкое распространение аморфные сплавы, которые получают в виде тонких лент (до 300 мкм) путем быстрого охлаждения жидкости (108-109 К/с). Например, жидкий сплав закаливают в узкий зазор между вращающимися навстречу друг другу металлическими валками. Аморфные сплавы не имеют пространственной решетки и поэтому очень прочны. Например, сплав состава Fe78Si10B12 имеет следующие свойства: в= 3400 МПа, Е = 87 ГПа, HV= 9100 МПа, = 0,3%, т.е. прочность заметно выше, чем у самой высокопрочной стали. Однако эти значения прочности не предел. Есть публикации о сплавах — металлических стеклах с в > 7000 МПа. Аморфные сплавы, например, состава Fe33Cr10Ni40P10C7 имеют очень высокую коррозионную стойкость из-за полной химической и структурной однородности и отсутствия границ зерен.
Известны сплавы — металлические стекла, которые по своим магнитным свойствам значительно превосходят известные динамные и трансформаторные стали и поэтому их применение дает большой экономический эффект.

При понижении температуры жидкого металла ниже Тo в нем образуются зародыши кристаллов, которые растут за счет жидкой фазы. Такие зародыши образуются из групп атомов, ближний порядок в которых близок к строению твердого кристалла.
Введем в рассмотрение следующие параметры:
n - число зародышей возникающих в единицу времени в единице объема металла - скорость образования зародышей, и
с - линейная скорость роста каждого кристалла.
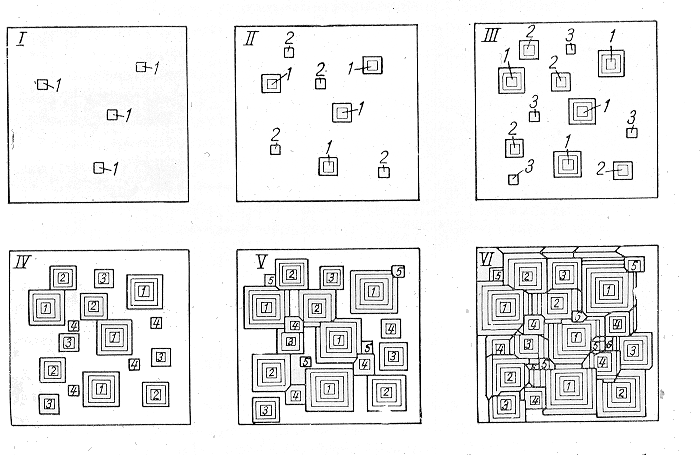
Общее число зерен в единице объема N (м-3) зависит от отношения n/с. N=a(n/с)3/4. Большое число мелких зерен возникает, если число образующихся зародышей n не велико, а линейная скорость роста их мала.
Рассмотрим теорию образования и роста кристаллов из расплава и факторы, влияющие на основные параметры затвердевания - n и с, принимая, что расплав нигде не соприкасается с твердой фазой, т. е. имеет место гомогенное зарождение.

Зародыши
могут возникнуть в жидкости в тех местах,
где энергия вследствие флуктуации
повышена на величину >Фk.
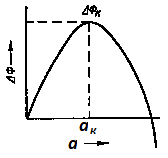
Чтобы рассчитать аk и Фk, нужно получить производную dФ/dа и приравнять ее к нулю.
аk = 4/fv.
Подставим это выражение в основное уравнение.
 (a)
(a)
Или
 .
.
Т.е.
свободная энергия на границе
кристалл-жидкость на 2/3 компенсируется
объемной свободной энергией, а на 1/3 -
энергией флуктуации Фk.

Критический размер зародыша зависит от степени переохлаждения.
Практически гомогенное образование зародышей встречается редко. Переохлаждение, необходимое для него достигает примерно 0,25To и может составлять 600-700оС. Зарождение под влиянием поверхности какого-либо твердого тела, соприкасающегося с жидкостью, происходит при значительном меньшем переохлаждении (1-10оС) и называется гетерогенным.
Пп-к < Пк-ж - условие для гетерогенного зарождения (Пп-к - поверхностная энергия подложка - кристалл, Пк-ж - поверхностная энергия кристалл - жидкость). При этом условии уменьшаются затраты энергии на образование поверхности раздела при возникновении кристаллов. Следовательно, для образования зародыша критического размера требуется меньшая энергетическая флуктуация и затвердевание начинается при меньшем переохлаждении. Твердая фаза - подложка, обладающая структурным и размерным соответствием с кристаллизующимся металлом облегчает зародышеобразование, т.е. уменьшает T и увеличивает n.
Обычно гетерогенное зарождение развивается под влиянием стенки изложницы, в которую заливают металл, что приводит к столбчатой кристаллизации. Для увеличения размера зерен используют перегрев металла выше To. При перегреве расплава с поверхности включений удаляются атомы металла, адсорбированные на ней и облегчающие образование зародышей (дезактивация включений).
Для уменьшения размера зерен используют модифицирование, которое заключается в введении в расплав малых количеств (0,001-0,1%) растворимой поверхностно активной примеси или нерастворимой примеси, обладающей структурным и размерным соответствием с кристаллизующимся металлом. Первая, адсорбируясь на поверхности возникших зародышей, уменьшает их поверхностную энергию и тем самым увеличивает величину n. Вторая способствует гетерогенному образованию зародышей.

 минимальна,
(i
- поверхностное натяжение, Fi
- площадь любой грани, приходящейся на
единицу объема металла). Суммирование
проводится по всем граням. В кристалле
при его образовании могут появиться
различные грани, в том числе и грани с
большим значением .
Однако, в процессе роста кристалла
поверхность таких граней должна
уменьшаться, по сравнению с гранями с
низким значением .
Например, рост граней в направлении 1-1
больше, и через некоторое время грань
с большим значением
исчезает (Рис.). Из закона Вульфа-Кюри
следует, что в кристалле скорость
перемещения грани пропорциональна ее
поверхностному натяжению. Форма
кристалла, соответствующая минимуму
удельной поверхностной энергии называется
равновесной.
минимальна,
(i
- поверхностное натяжение, Fi
- площадь любой грани, приходящейся на
единицу объема металла). Суммирование
проводится по всем граням. В кристалле
при его образовании могут появиться
различные грани, в том числе и грани с
большим значением .
Однако, в процессе роста кристалла
поверхность таких граней должна
уменьшаться, по сравнению с гранями с
низким значением .
Например, рост граней в направлении 1-1
больше, и через некоторое время грань
с большим значением
исчезает (Рис.). Из закона Вульфа-Кюри
следует, что в кристалле скорость
перемещения грани пропорциональна ее
поверхностному натяжению. Форма
кристалла, соответствующая минимуму
удельной поверхностной энергии называется
равновесной.
Поверхностное натяжение тем меньше, чем выше плотность укладки атомов в данной грани. Например, в ГЦК кристаллах плоскости {100} обладают большим поверхностным натяжением, чем плоскости {111}.

Как происходит рост кристалла из расплава?
Рост кристалла происходит путем послойного присоединения атомов из жидкости. Пусть на поверхности имеется незавершенный слой (рис.). Единичный атом (атом 1) не может удержаться на плотноупакованной грани. Атомы 2 и 3 из расплава у края незавершенного слоя удерживаются значительно сильнее, чем атом 1. Если нет незавершенного моноатомного слоя присоединившийся из расплава атом не сможет удержаться на плотноупакованной грани кристалла из-за теплового движения.


dV/d с3n, Максимум макроскопической скорости затвердевания лежит между максимумами n и c.

сколько
бы атомов к ней не присоединилось. Из-за
того, что по длине ступеньки атомы
присоединяются к ней с неодинаковой
скоростью, ступенька искривляется и
превращается в спираль. Спирали роста
обнаруживают экспериментально.
Таким образом, при наличии винтовой дислокации, выходящей на поверхность, рост кристалла может идти без образования двухмерных зародышей на плотноупакованных гранях.
Форма кристаллов и структура слитка
При малом переохлаждении чистых металлов (т.е. Т-маленькое) в начале кристаллизации образуются правильно ограненные кристаллы равновесной формы.
В зависимости от условий кристаллизации и степени загрязненности могут возникать кристаллы иной формы: пластинчатые, игольчатые, в виде сфероидов и т. п. Однако, наиболее распространенной формой является дендритная (древовидная).

Форма растущего кристалла зависит от температурных условий в расплаве и на поверхности раздела.
Пусть необходимое для кристаллизации чистого металла переохлаждение жидкости поддерживается путем отвода тепла через твердую фазу (рис на след. стр.)
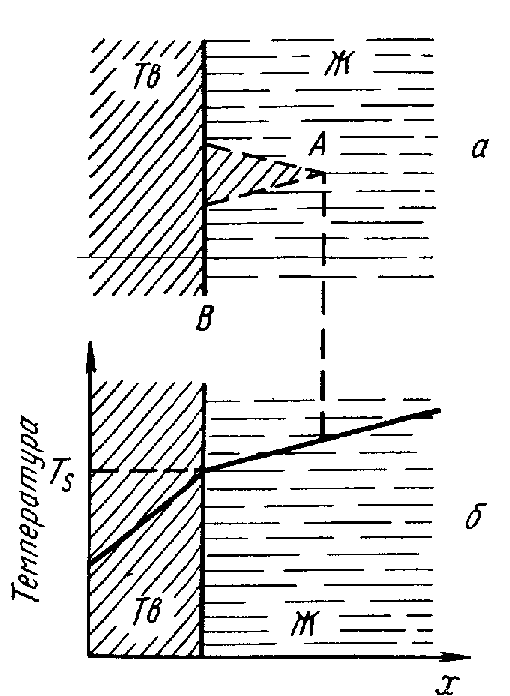
Этот случай имеет место, когда температура жидкой фазы по мере удаления от поверхности раздела с твердой фазой повышается, т. е. в жидкости имеется положительный температурный градиент.
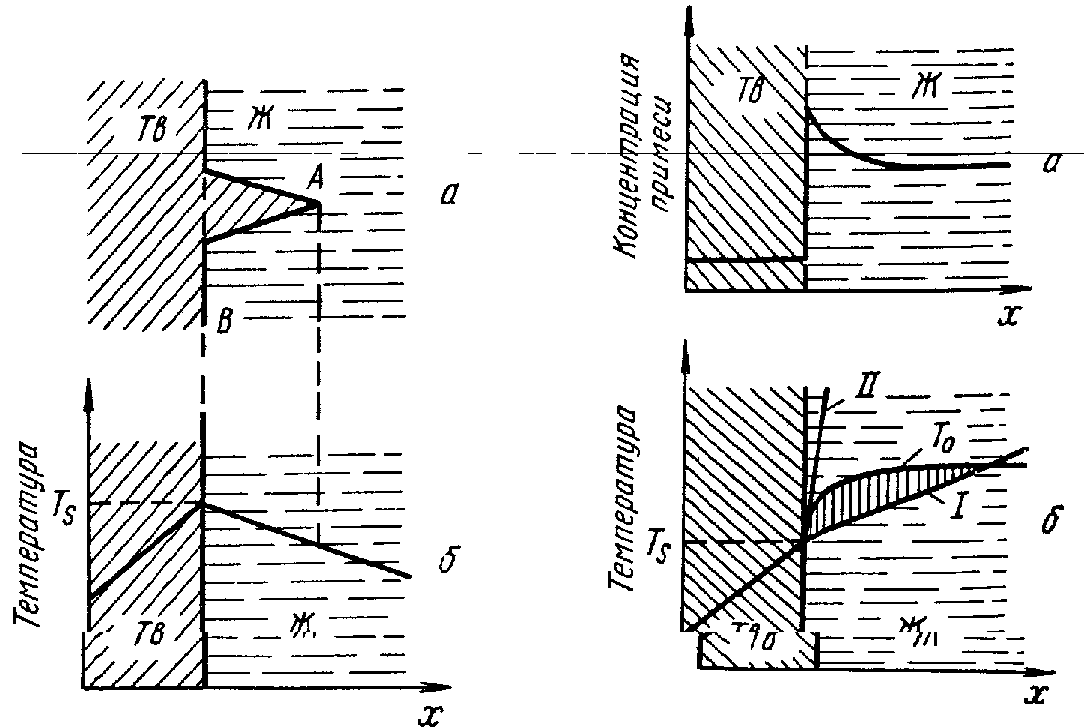
При наличии в металле примесей дендриты могут развиваться даже в случае, положительного температурного градиента в расплаве. Если растворимость примеси в твердой фазе меньше, чем в жидкой, то примесь будет скапливаться в жидкой фазе у поверхности раздела, понижая в этой области температуру равновесия То (рис. ). В этом случае при небольшом положительном температурном градиенте (рис., б, кривая 1) в жидкости создается зона переохлаждения, показанная вертикальной штриховкой. Но переохлаждение при этом связано с изменением концентрации примеси в расплаве перед фронтом кристаллизации. Поэтому такое переохлаждение называется концентрационным.
Таким образом, при наличии концентрационного переохлаждения поверхность раздела не может быть гладкой. В случае большей протяженности зоны концентрационного переохлаждения выступы развиваются сильнее и дают начало роста дендритам.
Анизотропия кристаллов проявляется при росте дендритов в том, что и главные, и побочные оси дендритов всегда растут в определенном кристаллографическом направлении: в металлах и сплавах с г.ц.к. и о.ц.к. решеткой — в направлении <100>. При этом они образуют наименьший угол с направлением теплоотвода.
На основании описанных выше закономерностей можно объяснить строение слитка.
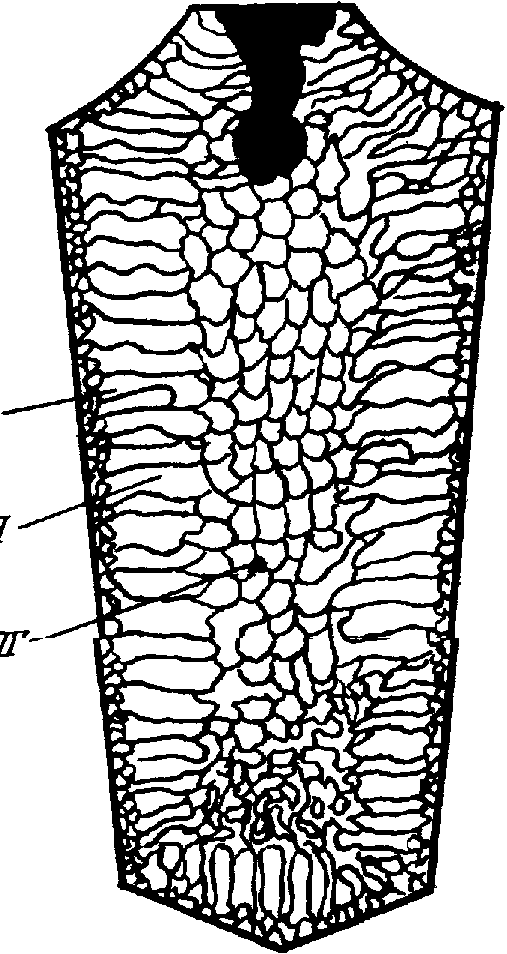
Мелкокристаллическая зона образуется в результате очень быстрого охлаждения жидкого металла при соприкосновении его с изложницей. При значительном Т образуются мелкие равноосные дендриты, у которых оси первого порядка ориентированы беспорядочно. Рост зоны 1 быстро прекращается из-за того, что выделяющаяся скрытая теплота повышает температуру жидкого металла у фронта кристаллизации. К этому моменту устанавливается хорошо направленный отвод тепла, перпендикулярный стенке изложницы. С этого момента при дальнейшем охлаждении дендриты растут по направлению к середине слитка. При этом «выживают» только такие дендриты, у которых с направлением теплоотвода совпадает направление максимальной скорости роста, т. е. <100>. Поскольку одновременно растет много дендритов, образуется столбчатая зона. В результате получается текстура литья. Если столбчатые дендриты растут до столкновения, то получающееся строение слитка называют транскристаллизацией. Транскристаллизация часто наблюдается в слитках чистых металлов. Однако такого рода столкновение столбчатых дендритов в стали бывает сравнительно редко.
Длина столбчатой зоны определяется, главным образом, переохлаждением расплава. Когда температура расплава на фронте кристаллизации повысится из-за выделяющейся теплоты кристаллизации настолько, что температурный градиент в жидкой фазе станет положительным, рост столбчатых дендритов прекращается. К этому моменту дендриты зарождаются во многих участках расплава и формируется центральная зона слитка. Зерна в этой зоне равноосные, ориентированы беспорядочно. Соотношение между размерами столбчатой и равноосной зон в слитке зависит от перегрева расплава, теплопроводности изложницы, содержания примесей в расплаве и т. д.
Возникновение дефектов решетки при затвердевании
В металлах и сплавах после затвердевания плотность дислокаций в зависимости от условий кристаллизации достигает 104—108см-2. Помимо дислокаций, в кристаллах, выращенных из расплава, наблюдаются также и малоугловые границы.
При затвердевании загрязненного металла примеси распределяются неравномерно. Скопление примесей на границах ячеек и между осями дендритов приводит к созданию в решетке упругих искажений, которые уменьшаются благодаря возникновению дислокаций.

По мере продвижения фронта кристаллизации в расплав твердая фаза охлаждается и равновесная концентрация вакансий в ней уменьшается. При охлаждении от высокой температуры может создаться пересыщение вакансиями. Избыточные вакансии уходят в стоки (дислокации и границы), а также образуют скопления в виде дисков (рис., а). При определенных размерах вакансионный диск становится неустойчивым и захлопывается. В результате образуется кольцеобразная дислокация (рис. б).
Выращивание монокристаллов.
Получение монокристаллов имеет большое научное и практическое значение. Монокристаллы позволяют изучать различные свойства вещества без учета влияния границ зерен: например, объемные параметры диффузии, анизотропию кристаллической решетки и др.
Монокристаллы высокой чистоты обладают рядом уникальных свойств, которые отсутствуют у поликристаллических материалов технической чистоты. Например, нитевидные монокристаллы железа с совершенной кристаллической структурой ("усы") имеют пределы прочности и текучести на 2-3 порядка выше, чем у поликристаллического железа. Монокристаллы W и Мо приобретают пластичность вплоть до гелиевых температур, становятся сверхпроводниками.
Монокристаллы выращивают искусственно, создавая условия роста кристалла только из одного центра кристаллизации. Выращивание монокристаллов основано на следующем принципе: теплоотвод должен быть таким, чтобы перед фронтом кристаллизации не создавалось переохлаждения.