
фтт лабы для ММ / Astanin_VV
.pdf
Рассмотрим механизм расщепления электронных орбиталей на примере ксенона. В свободном атоме ксенона шесть p-электронов попарно сопряжены. Три пары электронов образуют три симметрич- ные равнобокие гантели, ориентированные вдоль
осей x, y и z. Каждая гантель представляет, по существу, два совме- щенных электронных облака, поскольку она соответствует двум электронам с антипа- раллельными спинами. На рис. 27 гантели элек- тронов с одним направ- лением спина представ- лены сплошными лини- ями, а с противополож- ным – пунктирными. Приведенная схема условна, поскольку
сложение трех электронных облаков с разными ml в отсутствие внешнего поля дает сферически симметричное суммарное облако.
Допустим теперь, что атом ксенона сближается с атомом фтора. Внешние электроны атома фтора имеют конфигурацию p5 и, следова- тельно, один электрон не спарен. При сближении атомов возникает спиновое взаимодействие электронных облаков. Облако неспаренно- го электрона фтора отталкивает облако электрона ксенона с парал- лельным направлением спина и притягивает облако электрона с ан- типараллельным направлением спина. В итоге гантели двух спарен- ных электронов атома ксенона становятся неравнобокими. Одна из них смещается в направлении к атому фтора, а другая – в противопо- ложном.
Вытянутое к фтору электронное облако p-электрона ксенона объединяется с электронным облаком p-электрона фтора, в ре- зультате чего возникает σ-связь, в которой участвуют два электрона с противоположными спинами. Природа этой связи такая же, как и ко- валентной в молекуле водорода. Вторая несимметричная p-орбиталь
63
может образовать σ-связь с другим атомом фтора; так возникает мо- лекула XeF2. Очевидно, что с атомами фтора могут также взаимодей- ствовать p-орбитали, ориентированные вдоль оси у, и тогда образует- ся молекула XeF4. Если во взаимодействие с атомами фтора вступают все три p-орбитали, то возникает молекула XeF6. В данном случае σ- связь имеет невысокую энергию, образованные ею молекулы не- устойчивы, но, тем не менее, она заслуживает внимания как связь за- полненных орбит так как, в комбинациях с другими видами связи оказывает существенное влияние на формирование кристаллов.
В заключении отметим, что природа химической связи едина. Различие заключается в степени ионизации атомов: в случае ионной связи она ближе к полной, в случае ковалентной – частичная. В лю- бом случае строение неметаллических кристаллов определяется направленностью электростатических полей.
2.4.Контрольные вопросы и задания
1.Как методом математического анализа определить значения U0 и r0 (рис. 18)?
2. При каких условиях возможна гибридизация уровней 2s-2p
в натрии (рис. 19)?
3.Гибридизация каких уровней может быть характерна для меди, циркония, кадмия, гафния?
4.Определите величину дипольного момента µ, взяв значения Uор и r из результатов лабораторных работ.
5.Ковалентная связь является направленной и насыщенной. Куда направлен вектор сил притяжения и чем определена насыщен- ность связи?
6.Какие факторы управляют величиной углов между направлениями ковалентной связи?
7.Какие общие черты и различия между ковалентной и ионной свя- зью?
8.С помощью рисунка 23 объясните, почему в случае ковалентной связи ионизация атомов считается частичной?
9.Одно из условий возникновения σ-связи – это наличие свободного уровня. Как это требование реализуется в соединениях ксенона?
10.Для расщепления заполненного энергетического уровня требуется избыточная энергия. Чем компенсируются эти затраты?
64

3. СТРОЕНИЕ НЕМЕТАЛЛИЧЕСКИХ КРИСТАЛЛОВ
3.1. Ионные кристаллы
Типичные ионные кристаллы образуют соединения щелочных металлов с галогенами – соли. Соли не используются как конструк- ционные материалы и представляют интерес в качестве модели для изучения природы ионной связи. Ионная связь присутствует во мно- гих керамических материалах и с этой точки зрения представляет практический интерес.
На рис. 28 приведена кристаллическая структура (элементарная ячейка) типичного ионного соединения NaCl, построенная методом трехмерной компьютерной эмуляции в системе Diamond 2.1. В таком кристалле в узлах решетки поочередно располагаются ионы Na+ и С1–, так что каждый ион натрия окружен шестью ионами хлора, да- лее следуют 12 ионов натрия, и наоборот, каждый атом хлора окру- жен шестью атомами натрия и т. д. Следовательно, для двухкомпо- нентных кристаллов кулоновский потенциал в точке, занятой поло- жительным ионом, можно вычислить как
|
|
e2 |
|
|
|
12 |
|
, |
||
Uk |
= − |
|
|
6 |
− |
|
|
+ ... |
||
|
|
|
||||||||
r |
2 |
|||||||||
|
|
|
|
|
|
|
||||
или для неограниченной кристаллической решетки
U |
|
= − |
e2 |
A , |
(24) |
k |
|
||||
|
|
r |
M |
|
|
|
|
|
|
|
где АM – константа, которую называют постоянной Маделунга; она зависит от типа кристаллической решетки и заряда ионов; r – рассто- яние между ионами.
Для возникновения устойчивой молекулы или ионного кри- сталла необходимо, чтобы силам кулоновского притяжения ионов противодействовали силы отталкивания, связанные с энергией Uот.
Полную энергию связи в ионном кристалле можно записать как
UC = 12 [E − I − Uот + Uk ],
где Е – сродство к электрону; I – энергия ионизации.
При расстоянии между ионами, соответствующем минимуму потенциальной энергии, силы отталкивания равны силам притяже-
65

ния, что соответствует равновесному, устойчивому состоянию моле- кулы или ионного кристалла.
Принципиально, электростатические силы могут притягивать любое количество ионов, и число ближайших соседей должно стре- миться к максимальному (К=12). Иначе говоря, ненасыщенность и ненаправленность ионной связи предполагает тенденцию к образова- нию решеток координационного типа. Практически ионные кристал- лы имеют невысокие координационные числа. Этому способствует несколько причин.
а |
б |
Рис.28. Модель элементарной ячейки кристалла NaCl.
AM = 1,748; K = 6, а – схематичное изображение, б – перекрытие внешних орбиталей.
Одна из них в том, что реальные значения координационных чи- сел определяются соотношением ионных радиусов ra/rk. Чем меньше разница радиусов анионов и катионов, тем выше возможное коорди- национное число. Так, для решетки NaCl (см. рис. 26, плоскость [100]) из представлений плотной упаковки твердых шаров следует, что ионы натрия заполняют октаэдрические пустоты между более крупными ионами хлора. Это соответствует
|
ra + rk |
= |
|
2 |
|
|
|
|
2 |
|
|
||
|
2r |
|
, откуда ra/rk = 0,41. |
|||
|
k |
|
|
|
||
|
|
|
|
|
||
В структуре другого |
|
типичного ионного кристалла CsCl |
||||
(рис. 29) ион цезия занимает октаэдрическую пору, образованную во- семью соприкасающимися ионами хлора. При этом получается, что ra/rk = 0,73. Реально наоборот, соотношение ra/rk = 0,73 предопреде-
66

ляет тип кристаллической решетки CsCl. Решетка хлористого цезия может быть представлена как две кубические примитивные подре- шетки, вставленные одна в другую со смещением на ½ периода по
трем координатам. |
|
|
||
В противоположность рассмот- |
|
|||
ренному примеру, в соединении ZnS |
|
|||
двухвалентные |
ионы |
существенно |
|
|
отличаются своими радиусами ra/rk |
|
|||
= 0,22. |
Отсюда, |
обе |
полиморфные |
|
модификации ZnS (рис. 30) имеют |
|
|||
невысокое координационное число. |
|
|||
В элементарной |
ячейке сфалерита |
|
||
ионы |
серы образуют |
кубическую |
|
|
гранецентрированную подрешетку, в |
|
|||
тетраэдрических порах которой рас- |
Рис. 29. Элементарная ячейка |
|||
полагаются ионы цинка. Решетка |
||||
вьюрцита имеет гексагональную ос- |
кристалла CsCl; AM = 1,763; K = 8 |
|||
нову, но связи между разноименны- ми ионами построены по тому же принципу.
Другая причина невысоких значений координационного числа заключена в том, что в ионных кристаллах ионная связь не является единственной. Измерением диэлектрических констант показано, что заряд ионов не вполне соответствует представлениям донорно– акцепторного взаимодействия. Даже в классическом NaCl заряды ионов заметно меньше единицы. Радиус ионов, рассчитанный из энергии электронных оболочек, несколько превышает значение ион- ных радиусов, полученных из рентгеноструктурных измерений меж- плоскостных расстояний в кристалле. И то, и другое свидетельствует о том, что взаимодействие ионов в кристалле не ограничивается чи- сто электростатическим притяжением. Электроны не полностью по- кидают ионы натрия и не полностью переходят на оболочку хлора. Волновые функции ионов перекрываются, а следовательно, суще- ствует заметная вероятность обратного перехода. Модель кристалли- ческой решетки NaCl с учетом перекрытия электронных оболочек показана на рис. 28, б.
Следует напомнить, что внешние оболочки ионизированных щелочных металлов имеют строение благородных газов. Это p6- орбитали. Электростатические силы стягивают ионы до перекрытия p6-орбиталей, приводя их к спиновому расщеплению (аналогично
67

рис. 25) и образованию σ-связи. Ортогональность p6-орбиталей задает кубический мотив многих ионных кристаллов. Например, σ-связи между ионами цезия (рис. 29) располагают их по углам куба. Анало- гично связаны между собой ионы хлора, расположенные в центре ку- ба. Разноименные ионы связаны электростатически. Таким образом, кубическая объемно-центрированная решетка CsCl образована в ре- зультате комбинации ионной и σ-связи.
а б
Рис. 30. Модель кристалла сфалерита (α-ZnS; AM = 1,638 – а) и кристалла вьюрцита (β-ZnS; AM = 1,641 – б); K = 4
При формировании решеток типа ZnS дополнительное влияние оказывают электростатические силы отталкивания между одноимен- ными ионами. Этот фактор особенно заметен для ионов с высоким значением заряда (Zn2+ и S2–). Сравните конфигурацию связей на рис. 30, а и на рис. 26. В обоих случаях связи образуют тетраэдр, обу- словленный максимальным удалением одноименных зарядов.
В приведенных выше примерах даны наиболее типичные ре- шетки ионных минералов, которые встречаются и в материалах тех- нического назначения. Большинство таких материалов (например, корунд Al2O3) имеет сложное кристаллическое строение с большим числом атомов в элементарной ячейке.
3.2. Ковалентные кристаллы
Формирование кристаллических структур на основе ковалент- ных p-связей также подчинено компромиссу между ортогонально- стью орбиталей и возможностью размещения соседних атомов. Например, решетка алмаза составлена из одинаковых атомов углеро- да, каждый из которых может быть соединен не более чем с четырь-
68
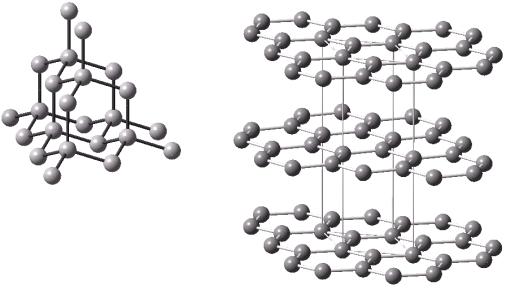
мя соседними атомами, т. е. К = 4. Отсюда решетка алмаза (рис. 31,а) напоминает решетку сфалерита, характерную для упаковки шаров со значительной разницей радиусов.
Решетка алмаза кубическая, с периодом a = 3,56 Å, содержит 8 атомов на элементарную ячейку. Атомы первой координационной сферы образуют тетраэдр, аналогичный молекуле метана с углом между связями 109,5°. Благодаря стопроцентной сбалансированной ковалентной σ-связи алмаз обладает наивысшей твердостью, прозрачен для видимого света, не проводит электрического тока. Аналогичные кристаллические решетки с К = 4 имеют другие элементы группы углерода – Si, Ge и Sn (серое), в которых преобла- дает ковалентная σ-связь. Для определения координационного числа ковалентных кристаллов используют правило K = 8 – N , где 8 – это максимальное число валентных s+p уровней, а N – номер группы элемента в периодической системе Д. И. Менделеева. Таким образом, перечисленные элементы 4 группы образуют решетки с К = 4.
а |
б |
Рис. 31. Модели кристаллических структур алмаза (а) и графита (б)
Идеальная сбалансированность σ-связи характерна только для алмаза. В других материалах имеет место частичная делокализация валентных электронов, придающая им полупроводниковые свойства. Комбинация σ- и π-связей приводит к возникновению кристалличе- ской структуры иного типа. Решетка графита гексагонального типа с параметрами а =2,46 и с =6,7 Å имеет слоистое строение (рис. 31,б). Каждый слой составлен из шестигранников с К = 3, наподобие моле- кул бензола, где каждый атом углерода соединен с соседями тремя
69
локализованными σ-связями и ½ π-связи. Здесь π-связи делокализо- ваны, т. к. на 12 связей приходится 6 электронов. Делокализованные электроны слабо связаны с узлами кристаллической решетки и обу- славливают электропроводность графита. Межслойная связь осу- ществляется слабыми межмолекулярными силами, поэтому слои графита легко разделяются сдвигом. Благодаря этому свойству гра- фит используют как антифрикционный материал. В условиях, ис- ключающих межплоскостной, сдвиг графит обладает высокой проч- ностью и используется в качестве основы жаропрочных композици- онных материалов.
По мере увеличения атомного номера элементов 4 группы кова- лентная связь ослабляется и добавляется металлической. Последний элемент этой группы – свинец обладает металлическими свойствами и характерной для металлов ГЦК решеткой.
Решетки с координационным числом К = 3 образуют элементы 5 группы, что соответствует правилу K = 8 – N, это P, As, Sb и Bi. В отличие от графита, слои, образованные σ-связями, не плоские, а зиг- загообразные. В объеме они образуют пакеты (рис. 32,а), при объ- единении которых возникает структура ромбоэдрического типа.
Элементы 6 и 7 групп в соответствии с правилом K = 8 – N име- ют по два и одному ближайшему соседу. В структуре атомы, соеди- ненные ковалентными связями, расположены спиральными цепочка- ми (рис. 32,б). Угол между направлениями связей до ближайших со- седей приближается к 90 º. Между собой цепочки связаны комбини- рованной ван-дер-ваальсовой и металлической связью. При объеди- нении цепочек образуется тригональная структура. В частности, в этой структуре кристаллизуется металлический селен. В другой, β- модификации селена цепочки атомов образуют замкнутые кольца. Атомы йода образуют ковалентные молекулы, которые соединяются в ромбоэдрическую структуру силами Ван-дер-Ваальса (рис. 32,в).
Более детальные представления о структуре ковалентных кри- сталлов можно получить, выполнив практическую работу по компь- ютерному моделированию в системе Diamond.
70

а |
б |
в |
Рис. 32. Модели структуры сурьмы (а), селена (б) и йода (в), построенные в Chem3d по принципу комбинации ковалентной
иван-дер-ваальсовой связи.
3.3.Контрольные вопросы и задания
1.Как изменится потенциальная энергия взаимодействия двух ионов при увеличении расстояния на 10 %?
2.Натрий и цезий относятся к одной и той же группе щелочных ме- таллов. Почему их соединения с хлором образуют разные кри- сталлические решетки?
3.Какие физические факторы препятствуют образованию ионных кристаллов с плотной упаковкой?
4.Состоит ли кристалл соли из молекул NaCl? Каковы отличия в строении ионных кристаллов и молекулярных органических мате- риалов?
5.В чем отличие элементарной ячейки кристаллической решетки CsCl от ОЦК решеток металлов?
6.При высокой температуре алмаз превращается в графит. Каковы термодинамические и физические причины этого перехода?
7.Какого типа подрешетки образуют структуру сфалерита?
8.Почему ковалентные кристаллы не имеют плотноупакованных решеток?
9.В какой решетке больше расстояние между соседними атомами – алмаза или графита?
10.Почему межатомное расстояние в плоскости (0001) графита суще- ственно меньше, чем между плоскостями?
11.Почему атомные слои, образованные σ-связями элементов 5-й группы, не плоские, как у графита, а зигзагообразные?
12.В чем причина хрупкости ковалентных кристаллов?
71
4.СТРОЕНИЕ МЕТАЛЛОВ
4.1.Общие представления о металлической связи
Металлы обладают рядом специфических свойств, отличающих их от других веществ. К таким свойствам относятся, прежде всего, высокие электро- и теплопроводность, возрастающие с понижением температуры. В газообразном состоянии специфические свойства ме- таллов, в частности, высокие тепло- и электропроводность не прояв- ляются. Металлические пары являются такими же изоляторами, как газы и пары любых других твердых веществ.
Поскольку специфические свойства металлов проявляются лишь в конденсированных состояниях (т. е. в жидком и твердом), то металлические свойства связывают с особенностями строения метал- лов в этих состояниях. Еще в конце XIX века Друде предположил, что большая электропроводность металлов определяется наличием в них свободных, не связанных с атомами, электронов. Свободные электроны возникают при конденсации металлических паров из-за ионизации конденсируемых атомов. Валентные, наиболее слабо свя- занные с ядрами электроны теряют связь с атомами и образуют в конденсированном металле самостоятельный коллектив электронов – электронный газ. Свободные электроны связаны не с отдельными атомами, а со всей совокупностью атомов конденсированного тела.
Коллективизация электронов приводит к возникновению связи между положительными ионами конденсированного металла – к воз- никновению сил сцепления. Подобно тому, как в молекуле водорода электронное облако двух электронов стягивает положительно заря- женные ядра в устойчивую систему, так и в металлическом теле электронный газ стягивает положительно заряженные ионы в устой- чивую систему атомов. Однако если при образовании молекулы во- дорода коллективизируются два электрона, то при конденсации ме- таллического пара коллективизируется огромное число электронов. В частности, при конденсации грамм-атома паров алюминия (26,98 г) коллективизируются 3·6,023·1023 электронов (6,023·1023 – число Аво- гадро; 3 – валентность алюминия).
Это чисто количественное различие в числе коллективизиро- ванных электронов приводит к качественно новому типу связи. От- личительная особенность ковалентной связи – ее насыщенность,
72
