
Термодинамические методы.
Совокупность термодинамических методов основана на законах термодинамики разбавленных растворов. Четкие закономерности изменения термодинамических свойств, присущие идеальным растворам, в случае полимеров проявлятся только в растворах с малой концентрацией, поэтому измерение этих свойств осуществляется на разбавленных растворах полимеров и результаты измерений, как правило, еще экстраполируются к бесконечному разбавлению.
В основе термодинамических методов лежит пропорциональная зависимость определенных свойств (температур замерзания, кипения, осмотического давления) растворов полимеров от числа растворенных макромолекул. Термодинамическое методы позволяют определять . К числу данных методов относятся мембранная осмометрия, криоскопия и эбулиоскопия.
Мембранная осмометрия. В основе лежит явление осмоса – переноса растворителя через полупроницаемую мембрану. Если растворитель отделить от раствора полимера мембраной (рис.11), то в начале химические потенциалы чистого растворителя μ0 и растворителя в растворе μ1 будут различны (μ0 > μ1).

Рисунок 11.
Стремясь
выровнять химические потенциалы,
молекулы растворителя будут диффундировать
в ячейку с раствором полимера. В результате
в ней повысится уровень жидкости
 (рис.11). Разность давлений по обе стороны
мембраны, вызывающая явление переноса
(осмоса) и выравнивания химических
потенциалов системы, называется
осмотическим давлением π. С увеличением
концентрации раствора полимера возрастает
разность между химическими потенциалами
растворителя и раствора. Чем больше
становится разность химических
потенциалов растворителя и раствора
(рис.11). Разность давлений по обе стороны
мембраны, вызывающая явление переноса
(осмоса) и выравнивания химических
потенциалов системы, называется
осмотическим давлением π. С увеличением
концентрации раствора полимера возрастает
разность между химическими потенциалами
растворителя и раствора. Чем больше
становится разность химических
потенциалов растворителя и раствора
 ,
тем больше π и тем больше
.
Следовательно, осмотическое давление
π является функцией концентрации c,
т.е. числа растворенных макромолекул
полимера. Зависимость осмотического
давления от концентрации полимера в
растворе выражается уравнением:
,
тем больше π и тем больше
.
Следовательно, осмотическое давление
π является функцией концентрации c,
т.е. числа растворенных макромолекул
полимера. Зависимость осмотического
давления от концентрации полимера в
растворе выражается уравнением:
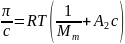 .
.
Указанная зависимость π/c от c линейная. С ее помощью можно определять среднечисловую молекулярную массу по отрезку RT/Mm, отсекаемому прямой на оси ординат (рис.12). Коэффициент A2 при c носит название второго вириального коэффициента и определяется характером взаимодействия полимера с растворителем.

Рисунок 12.
Величину
осмотического давления в мембранных
осмометрах можно измерять в статическом
и динамическом режимах. Устройство и
принцип действия статического осмометра
показаны на рис. 11. Недостатком статического
метода является длительность измерения,
так как диффузия через мембрану с
достижением постоянной величины
- медленный процесс. Современные осмометры
основаны на принципе динамического
равновесия, т.е. регулируемого
уравновешивания осмотического давления
гидростатическим, в результате чего
осмотическое равновесие достигается
за 5…7 минут. Мембранная осмометрия
позволяет определять молекулярную
массу в диапазоне
 .
.
Метод
криоскопии. Для определения молекулярной
массы криоскопическим методом используется
эффект снижения температуры замерзания
жидкости при растворении в ней полимера.
Величина
 ,
на которую понижается температура
замерзания растворителя, зависит от
числа молекул растворенного вещества
– полимера. Это позволяет определять
среднечисловую молекулярную массу Mn.
Связь
с Mn
описывается уравнением:
,
на которую понижается температура
замерзания растворителя, зависит от
числа молекул растворенного вещества
– полимера. Это позволяет определять
среднечисловую молекулярную массу Mn.
Связь
с Mn
описывается уравнением:
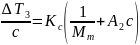 .
.
Исходя из прямолинейной зависимости приведенной величины от концентрации раствора c, молекулярную массу находят по отрезку Kc/Mn, отсекаемому указанной прямой на оси ординат. Константа Kc называется криоскопической константой, которая зависит от свойств чистого растворителя:
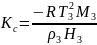 ,
,
где T3, M3, ρ3, H3 – соответственно температура замерзания, молекулярная масса, плотность и теплота плавления растворителя.
Криоскопией
возможно определение Mn
до
 .
.
