
Галогени. Фтор. Хлор
I. ns2np5
Галогени – «ті, що не розчиняють солі»
наявність одного неспареного електрона визначає кількісну для всіх елементів валентність 1.
Cl, Br, I, At мають вакантний nd – підрівень, орбіталі якого також мають брати участь в утворенні хімічних зав’язків, та проявляти ступені окиснення +1, +3, +5, +7.


 ͟ ͟ ͟
͟ ͟
͟ ͟ ͟
͟ ͟





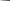
͟ ͟ ͟
͟
Найстійкіший ступінь окиснення -1.
F – дуже малий радіус = дуже висока енергія іонізації => ступінь окиснення -1.
У ряді CL – Br – I – At зростає радіус => зменшується енергія спорідненості до електрона та зменшення енергія іонізації => зменшення електронегативності.
Виняток F – менша енергія спорідненості до електрона, порівняно з Cl. Це зумовлено малими розмірами атома F => посилюється електростатичне відштовхування електрона, який приєднався, електронною системою атом.
Молекули галогенів двохатомні, неполярні.
F2 – Cl2 – Br2 – I2 – At2
В молекулах – неполярний ковалентний зв`язок; в ряду зростає здатність молекул до деформації, тобто підвищується поляризованість, що зумовлює посилення міжмолекулярну взаємодію. Тому в ряду спостерігається перехід від газоподібного F2 до твердого I2.
Зі збільшенням радіусу в ряду зменшується окиснювальні властивості і зростають відновні.
F, Cl – типові галогени
Br, I, At – підгрупа брому.
Фтор
I. Найактивніший з усіх елементів у вільному стані. Окиснює всі прості
речовини крім He, Ne, Ar, O2 та N2. Ступінь окиснення -1.
II. Поширення в природі.
Тільки у вигляді фторидів
Ca F2 – орхлорит
Co3(PO4)2 * CaF2 – Co5F(PO4)3) – анатит
Na3[AlF6] – кріоліт
З гарячих надр землі у вигляді HF з водяною парою
В земній корі 2,7 * 10-2 %
У ґрунті 0,02% (2 * 10-2%)
У річковій воді 2*10-5%
В океанах 1*10-4%
У тваринних організмах в кістках і зубах. Формула зубної емалі наближається до формул апатитів. Нестача фтор – карієс, надлишок – крихкість зубної емалі.
III. Відкриття руйнують
«Фтор» - « той, що руйнує» («руйнуючий»)
«Флуор» - « той, що тече» («текучий»)
1780 рік К. В. Шеєле – припущення існування нового елементу, що входить до складу плавикової кислоти.
Томас і Тефра Нокс, Д. Никмс, П. Лойет, Хеморі Деві, Ж. Гей-Люссак, Л. Тернер – пробували отримати фтор, але отруїлися й тяжко хворіли.
А. Лавуазьє, Є. Фремі, М. Фародей – намагалися, але так і не добули фтор.
26.06.1886 – Анрі Муассон – добув фтор електролізом безводного HF (має містити залишки KF)
А . Муассон – почав з`ясовувати мідні сосуди – вони вкривалися захисним шаром фториду міді. До цього часу використовували …. типові – й кожен грам фтору « змішував» 5-6 Рt.
IV. Добування
електролізом безводного НF – у середовищі КН2F3(KF.2HF) за t=80-1200C або у середовищі KHF2(KF.HF) за температурою 240-3000С. На катоді водень, на опорі F2.
Устаткування для роботи з різким і газоподібним фтором виготовляють із сталі, міді або алюмінію нікелю – на їх поверхні утворюються цільні наявні плівки фторидів, які захищають від подальшої корозії.
V. Фізичні властивості.
За з.у. – блідо - жовтий газ з різким специфічним запахом.
t пл. = -219,70С, t.мін = -1880С.
Газоподібний F2 розчиняється у різному HF, різкий –необмежено у скропленому кисні.
VI. Хімічні властивості.
- Усі похідні фтору, навіть кисневмісні, є фториди. Ступінь окиснення -1
- Найсильніший окисник. Окиснює всі прості речовини крім He,Ne,Ar,O2 та N2.
- C, Si, P, S, більшість металів у вигляді порошків займаються в середовищі фтору за температурою 20-3000С.
- У сполуках із фтором елементи виявляють свій найвищий ступінь окиснення:
S +3F2 = S+6 F6 -1 2P+5F2 = 2P+5 F5 -1
Ці реакції проходять навіть за температури різного повітря (-1900С)
- у середовищі фтору горять навіть скло ( у вигляді вати ) та вода:
SiO2 -2 +2F2 0 = SiF4 -1 + O20 2H2O-2 +F2 0 = 4HF -1 + O2 0
SiO2 відновник H2O-2 відновник
- фтор безпосередньо окиснює навіть важкі благородні гази: Кv, Хе, Rn (радон)
Kv+F2=KvF2;

Xe+F2=XeF2;
Xe+2F2=XeF4 залежно від умов
Висока хімічна активність фтору пояснюється:
-малою міцністю зв’язків в молекулі F2;
- високою міцністю зв’язків з іншими елементами в яких є великий внесок іонності.
VII. Сполуки
