
- •Предельные углеводороды. Алканы
- •Алкены. Олефины
- •Диеновые углеводороды (диены)
- •Алкины. Ацетиленовые углеводороды
- •Ароматические углеводороды. Арены
- •Предельные одноатомные и многоатомные спирты
- •Плавлением сульфокислот со щелочами (чаще всего используется NaOh)
- •Качественная реакция на фенол:
- •Альдегиды и кетоны
- •2Ch3 – coh ch3 – ch(oh) – ch2 – coh (альдоль)
- •Литература:
- •Оглавление:
Диеновые углеводороды (диены)
Рассмотрим сопряженные диены.
Общая формула CnH2n-2.
Наиболее важные члены гомологического ряда:
1,3 – бутадиен (дивинил) СН2 = СН – СН = СН2 и
2 – метил – 1,3 – бутадиен (изопрен) СН2 = С – СН = СН2
СН3
Номенклатура. По систематической номенклатуре обе двойные связи находятся в главной цепи. Нумерация атомов углерода С - с того конца, где ближе двойные связи. Окончание – диен.
Изомерия:
углеродного скелета;
положения двойных связей;
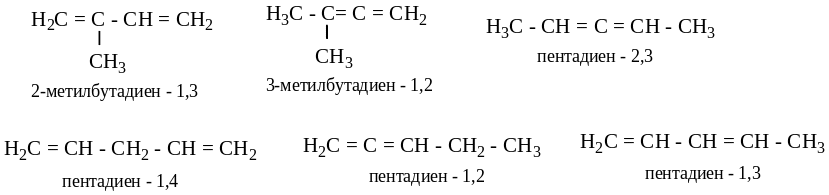
3) цис ↔ транс;
4) межклассовая (с алкинами).
Строение. Все атомы углерода С находятся в одной плоскости, углы между связями 1200, sp2 – гибридизация.
Возникает такое влияние атомов в молекуле, когда перекрывание π – элктронных облаков двойных связей приводит к образованию общего π -электронного облака, которое охватывает всю систему сопряжения (π, π – сопряжение или мезомерный эффект).
Физические свойства: Бутадиен – 1,3 - легко сжижающийся газ с нейтральным запахом. Изопрен – жидкость с tкип. = 340 С.
Получение.
Дегидрированием алканов (условия: 500…600 0С, катализаторы – Al2O3, ZnO, Cr2O3).
Синтезом из этанола (метод С.В. Лебедева):
![]()
(катализаторами могут быть MgO, Cr2O3).
Дегидратацией 1,3 - или 1,4 бутандиола (t0; концентрированная H2SO4):
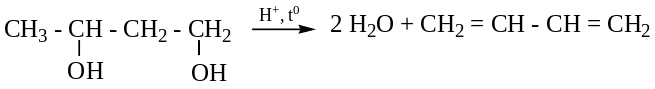
Химические свойства.
Характерны реакции присоединения, которые приводят к образованию смеси двух продуктов 1,2 и 1,4 – присоединение (основной) с перемещением двойной связи. Электрофильное присоединение - АЕ.
Присоединение Hal2, H2, Hhal (правило В.В. Марковникова)
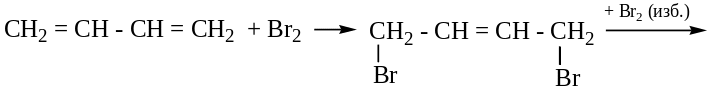
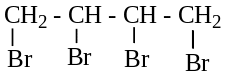
![]()
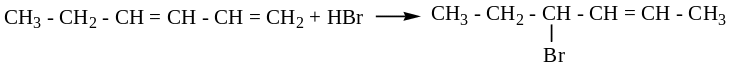
Горение
![]()
Полимеризация – получение каучуков
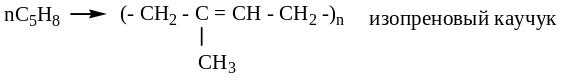
![]()
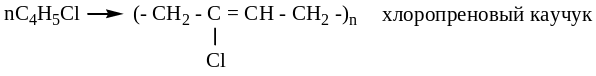
Сополимеризация 1,3–бутадиена со стиролом в соотношении 4:1 дает бутадиен-стирольный каучук:
![]()
Сополимеризация 1,3–бутадиена с акрилонитрилом дает бутадиен-нитрильный каучук:
![]()
Резины получают из каучука «смешиванием макромолекул за счет большинства оставшихся С=С связей S ― S мостиками. Полное смешивание макромолекул приводит к образованию твердого, неэластичного эбонита.
Задачи
Определите выход реакции С.В. Лебедева, если на изготовление одной пары резиновых сапог пошла резина, полученная из 850 г бутадиенового каучука, для чего потребовалось в 1985 г. 96 % этанола, выход реакции полимеризации 80%. Тип № 8.
Решение:
Практическая масса 1,3 – бутадиена составляла: m(C4H6) = 850/0,8 = 1062,5 г.
Найдем массу этилового спирта: m(C2H5OH) = 1985 ∙ 0,96 = 1905,6 г.
Молярная
масса этилового спирта: M(C2H5OH)
= 24 + 6 + 16 = 46 г/моль. Найдем количество
вещества этилового спирта:
![]() .
.
Реакция С.В. Лебедева:
![]()
Из уравнения реакции следует, что число молей 1,3 – бутадиена будет равно: n(C4H6) = 41,43/2 = 20,71моль.
Молярная масса 1,3 – бутадиена: М(C4H6) = 48 + 6 = 54 г/моль.
Теоретическая
масса 1,3 – бутадиена:
![]() .
.
Выход реакции С.В. Лебедева:
Ответ: η = 95 %.
В бытовом радиоприемнике произошло возгорание от перепада напряжения в сети, воспламенилась изоляционная резина. Не отравятся ли члены семьи, если войдут в комнату, площадью 12 м2, с высотой потолка 2,5 м. ПДК(SO2) = 3 мг/л, а сгоревшая резина была получена из 40 г этанола с выходом 80%, содержание серы в ней 5…19 %? (ПДК – предельно допустимая концентрация данного вещества.) Тип № 8.
Решение:
Объем комнаты составит: V = 12 ∙ 2,5 = 30 м3 = 30 ∙ 103 л.
Уравнение реакции получения дивинила из этилового спирта (метод С.В Лебедева):
![]()
Найдем
число молей этилового спирта:
![]() ,
тогда из уравнения реакции следует, что
число молей дивинила с учетом его 80%
выхода, составит: n(C4H6)факт.
= 0,87/2 ∙ 0,8 = 0,35 моль.
,
тогда из уравнения реакции следует, что
число молей дивинила с учетом его 80%
выхода, составит: n(C4H6)факт.
= 0,87/2 ∙ 0,8 = 0,35 моль.
Считаем,
что m(C4H6)
≈ mрезины.
Найдем массу резины:
![]() .
.
Масса серы в резине составит: m(S) = 18,9 ∙ 0,1 (10 %) = 1,89 г.
Уравнение реакции горения серы:
S + O2 → SO2
Молярные
массы серы: M(S)
= 32 г/моль; сернистого газа: М(SO2)
= 64 г/моль. Определим количество вещества
серы:
![]() ,
из уравнения реакции следует, что число
молей сернистого газа составит тоже
0,059 моль. Тогда его масса будет:
,
из уравнения реакции следует, что число
молей сернистого газа составит тоже
0,059 моль. Тогда его масса будет:
![]()
Концентрация SO2 в комнате: С(SO2) = 3,78/0,03 = 0,126 мг/л, что ниже ПДК.
Ответ: Отравления не будет.
Выберите название вещества СН2 = СCl – C(CH3) = CCl – CH3
2,4 – дихлор - 3- метилпентадиен – 2,4;
2,4 – дихлор - 3- метилпентен – 2;
3 – метил - 2,4 – дихлор - пентадиен – 2,4;
2,4 – дихлор- 3- метилпентадиен – 1,3.
Ответ: правильно 4 - ый.
