
- •Предельные углеводороды. Алканы
- •Алкены. Олефины
- •Диеновые углеводороды (диены)
- •Алкины. Ацетиленовые углеводороды
- •Ароматические углеводороды. Арены
- •Предельные одноатомные и многоатомные спирты
- •Плавлением сульфокислот со щелочами (чаще всего используется NaOh)
- •Качественная реакция на фенол:
- •Альдегиды и кетоны
- •2Ch3 – coh ch3 – ch(oh) – ch2 – coh (альдоль)
- •Литература:
- •Оглавление:
Московский государственный технический университет
имени Н.Э.Баумана
Методические указания
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ОРГАНИЧЕСКОЙ ХИМИИ ДЛЯ РАЗЛИЧНЫХ КЛАССОВ СОЕДИНЕНИЙ
для студентов специальностей
«Безопасность жизнедеятельности в техносфере» и «Охрана окружающей среды и рациональное использование природных ресурсов»
(кафедра Э-9)
Составители:
М. Б. Степанов
Л. А. Хмарцева
Е. А. Якушева
Е.В. Быстрицкая
А.М. Голубев
Москва
Издательство МГТУ им. Н.Э.Баумана
2012
Предисловие
Методические указания к решению задач по органической химии содержат их основные типы по различным классам органических соединений в соответствии с утвержденной в МГТУ им. Н.Э. Баумана программой для студентов специальности «Экология и промышленная безопасность» (кафедра Э-9).
В указаниях подробно рассмотрены примеры решения различных типов задач по органической химии, предлагаемых на кафедре химии при защите лабораторных работ, выполнении домашнего задания.
Учащимся необходимо показать знание химии в различных областях практической деятельности: в профессиональной, бытовой, при решении экологических проблем. Задачи содержат информацию о свойствах веществ, явлениях и процессах, реально проявляющихся в окружающей человека среде.
Задачи для самостоятельной работы могут быть различной сложности, что способствует повышению познавательной активности студентов.
Приведенный список литературы поможет при решении задач и усвоении теоретического материала.
В курсе органической химии рассматривают задачи следующих типов:
нахождение плотности паров органических веществ и относительной плотности одного вещества по другому и обратные;
вычисление массовых долей и (или) массового отношения элементов в органическом веществе и обратные – вывод формул по массовому отношению или массовым долям элементов в веществе, если дана молярная плотность паров или относительная плотность паров вещества по некоторому газу;
вывод формулы органического вещества по массам, количествам или объемам продуктов сгорания или иной реакции;
вывод формулы органического соединения с последующим написанием его изомеров и гомологов;
вывод массового или объемного состава газовой смеси по известным значениям (количеству, массе, объему) продуктов горения или иной реакции;
вывод состава газовой смеси по изменению давления в реакционном сосуде или изменению средней молярной массы смеси;
расчет равновесных концентраций газов, исходя из исходных концентраций и константы равновесия, и обратная задача;
расчет массы, количества или объема одного из продуктов реакции, если одно из исходных веществ дано в избытке и указан объемный или массовый выход продукта, и обратные задачи;
вычисление степени полимеризации, исходя из массы мономера и выхода реакции, и обратная задача – вычисление числа макромолекул по степени полимеризации и выходу реакции.
Задачи подразделяются по основным классам органических соединений.
Предельные углеводороды. Алканы
Общая формула CnH2n+2
Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. В настоящее время общепринятой является систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии). Первые четыре представителя углеводородов имеют названия: метан, этан, пропан, бутан. Начиная с пентана названия углеводородов образуют от греческих числительных* с добавлением суффикса – ан: пентан, гексан, гептан, октан, нонан, декен и т.д.
*Греческие числительные (до десяти): 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта, 9 – нона, 10 – дека.
Если, например, необходимо назвать соединение, поступают следующим образом:
выбираем главную цепь (самую длинную и разветвленную).
нумеруем атомы углерода С с того конца, где больше заместителей, чтобы радикалы получили наименьшие номера. (Сумма цифр заместителей – локантов – должна быть наименьшая).
заместители называем по старшинству или в алфавитном порядке.
затем даем название углеводорода по главной цепи.
Пример:

2,5 – диметил – 3 – этилгексан
Изомерия. Основной вид – структурная изомерия углеродного скелета.
Строение. Все атомы углерода - в sp3 гибридном состоянии, угол связи между атомами С составляет - 109,50. В молекулах имеются только δ связи, которые достаточно прочные.
Физические свойства. При содержании в молекуле числа атомов углерода 1…4 – углеводороды находятся в газообразном состоянии, 5…17 - (нормального, т.е. неразветвленного строения) – жидком, равном или более 18 – твердом. Разветвленные углеводороды имеют более низкие температуры кипения.
В воде алканы нерастворимы. Однако они хорошо растворяются в органических растворителях и друг в друге.
Газообразные алканы не имеют запаха и цвета, легче воды.
Основные способы получения алканов.
Из природных источников (угля, нефти, газа).
Каталитическим гидрированием органических соединений (циклоалканов, алкенов, алкинов, диенов, аренов):
![]()
По реакция Вюрца:
![]()
Из галогенопроизводных при замещении галогена водородом:
![]()
По реакция Гриньяра:
![]()
Декарбоксилированием солей органических кислот (реакция Дюма):
![]()
Из синтез-газа:
![]()
Химические свойства.
Алканы
- малоактивные соединения, реагируют в
жестких условиях (при нагревании или
при освещении УФ – светом (hν),
а также в присутствии катализаторов).
Возможными для них являются реакции
замещения, в которых участвуют, обладающие
высокой энергией весьма реакционноспособные
радикальные частицы (реакции радикального
замещения - SR).![]()
Замещение
![]()
Термическое разложение алканов – крекинг
![]()
Гетерогенно-каталитическое дегидрирование. Катализаторы Pt, алюмосиликаты.
C2 - C5 → алкены (смесь),
C6 - C8 → ароматические углеводороды.
Изомеризация в присутствии катализаторов (AlCl3; AlBr3) для углеводородов с числом атомов С ≥ 4
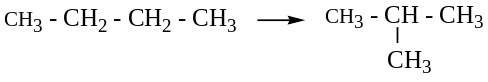
Горение
![]()
Газофазное каталитическое окисление
![]()
Задачи
1. Для производства румян используют вазелиновое масло, состоящее, в основном, из смеси алканов С20Н42 и С22Н46. Определите процентный состав этой смеси, если при сгорании массы 155,35 г образуется 185,17 л углекислого газа (н.у), объемный выход по реакции горения 75 %. (Тип № 5).
Решение:
В результате реакций сгорания алканов образуются углекислый газ и вода:
![]()
![]()
Найдем число молей углекислого газа (СО2) по формуле:
![]() ;
где Vm
= 22,4 л/моль (молярный объем газа при
нормальных условиях: Т
= 273 К, р
= 1 атм (760 мм. рт. ст. )).
;
где Vm
= 22,4 л/моль (молярный объем газа при
нормальных условиях: Т
= 273 К, р
= 1 атм (760 мм. рт. ст. )).
Тогда количество вещества углекислого газа составит:
n(CO2)реальное = 185,17/22,4 = 8,267 моль.
С учетом 75% - ного выхода n(CO2)теоретическое = 8,267/0,75 = 11,022 моля
Пусть число молей С20Н42 будет - х, а число молей С22Н46 = y, следовательно, первое уравнение имеет вид:
20 х + 22 у = 11,022 (1)
Молярные
массы алканов:
М(С20Н42)
= 282 г/моль; М(С22Н46)
= 310 г/моль. Так как
![]() ,
то тогда, второе уравнение имеет вид:
,
то тогда, второе уравнение имеет вид:
282 х + 310 у = 155,35 (2)
Решаем систему из двух уравнений. Из уравнения (1) найдем значение х:
х = 0,551 – 1,1 у (3)
Подставляем это выражение в уравнение (2) и находим значение у:
155,41 – 0,2 у = 155,35
Отсюда у = 0,3 моль. Из уравнения (3) х = 0,22 моль.
Найдем
массу С20Н42:
![]() г; тогда по формуле
г; тогда по формуле
![]() определим процентный состав С20Н42:
определим процентный состав С20Н42:
![]() .
Следовательно W(С22Н46)
= 60,06 %
.
Следовательно W(С22Н46)
= 60,06 %
Замечание: при расчетах следует брать значения чисел с точностью до третьего знака после запятой, что связано с большими коэффициентами в стехиометрических уравнениях.
2. Перед городским праздником на нефтеперегонном заводе решили заполнить шарики различными предельными углеводородами, полученными при перегонке нефти, чтобы поднять их в воздух. Шарики, заполненные какими углеводородами, могут подняться в воздух? Молярная масса воздуха 29 г/моль. Тип № 1.
Решение:
Запишем первые два члена гомологического ряда алканов и их молярные массы. Определим плотности алканов по воздуху:
М(СН4) = 16 г/моль; М(С2Н6) = 30 г/моль;
Относительная
плотность
первого газа по второму обозначается
D
и представляет собой отношение массы
определенного объема одного газа к
массе такого же объема другого газа
(взятого при тех же условиях):
![]() ,
где М2
– молярная масса воздуха. Часто плотность
газа определяют по отношению к воздуху.
Хотя воздух является смесью газов, все
же говорят о его средней молярной массе.
Она рана 29 г/моль.
,
где М2
– молярная масса воздуха. Часто плотность
газа определяют по отношению к воздуху.
Хотя воздух является смесью газов, все
же говорят о его средней молярной массе.
Она рана 29 г/моль.
Тогда: Dвозд = 16/29 = 0,55 < 1 – шар полетит;
Dвозд = 30/29 = 1,1 > 1 – шар не полетит, поэтому проверять остальные алканы бесполезно.
Ответ: Метан. Не следует забывать о его горючести, поэтому надежнее пользоваться гелием.
Выведите формулу углеводорода – основного компонента газовой смеси, используемой для ремонты дорог, если его относительная плотность по кислороду
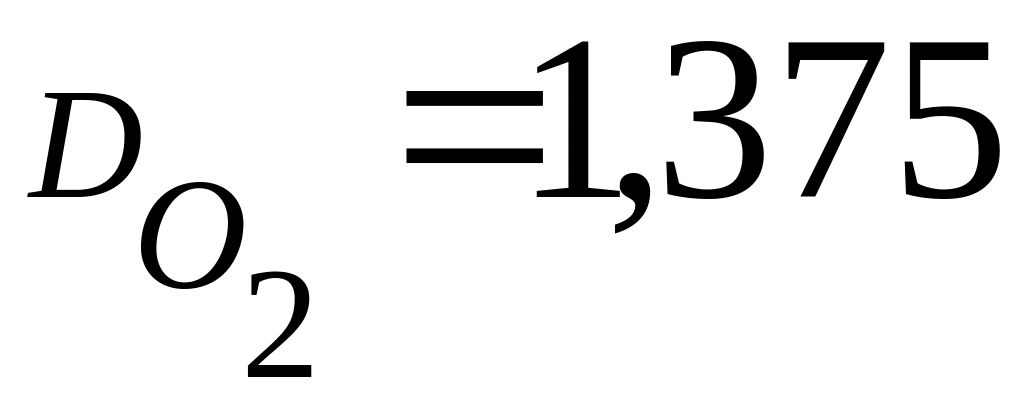 и он является алканом. (Тип № 1, обратная
задача).
и он является алканом. (Тип № 1, обратная
задача).
Решение: Относительная плотность вещества рассчитывается по формуле: , где М1 – молярная масса неизвестного углеводорода, М2 – молярная масса кислорода (32 г/моль). Отсюда:
М1
=
![]() ∙
32 = 1,375 ∙ 32 = 44 г/моль;
∙
32 = 1,375 ∙ 32 = 44 г/моль;
Так как неизвестное вещество относится к алканам, их общая формула C2nH2n+2, то, таким образом, М(C2nH2n+2) = 12n + 2n + 2 = 14n + 2 = 44
Из уравнения n = 3, т.е. искомое вещество – пропан.
Ответ: С3Н8.
Синтез этилена чаще всего проводится крекингом этана. Этилен, как известно, является мономером в реакции полимеризации для получения полиэтилена. При крекинге этана происходит следующая обратимая реакция:
![]()
Пусть равновесные концентрации участников реакции составляют
[C2H6] = 6 моль/л; [C2H4] = 4 моль/л.
Определить константу равновесия Кс дегидрирования этана и его начальную концентрацию. Начальные концентрации продуктов раны нулю. (Тип № 7).
Решение: Выражение константы равновесия для реакции имеет вид:
![]()
В условии задачи не дана равновесная концентрация водорода, однако из стехиометрического уравнения реакции очевидно, что [H2] = [C2H4] = 4 моль/л.
Тогда найдем выражение КС из уравнения:
![]()
Исходная концентрация этана составит: С0(С2Н6) = [C2H6]равн + Спрорег.
С учетом стехиометрического уравнения, этана прореагировало 4 моль/л. Таким образом: С0(С2Н6) = 6 + 4 = 10 моль/л.
Ответ: КС = 2, 667; С0(С2Н6) = 10 моль/л.
В каком массовом соотношении используют смесь пропана и бутана для заправки садовых газовых баллонов вместимостью 5 кг, если при использовании газа из одного такого баллона образуется 7,653 м3 углекислого газа (н.у)?
Решение: Найдем количество вещества углекислого газа (СО2) по формуле:
![]() ;
где Vm
= 22,4 л/моль (молярный объем газа при
нормальных условиях: Т
= 273 К, р
= 1 атм (760 мм. рт. ст. )).
;
где Vm
= 22,4 л/моль (молярный объем газа при
нормальных условиях: Т
= 273 К, р
= 1 атм (760 мм. рт. ст. )).
Отсюда: n(CO2) = 7653/22,4 = 341,65 моль.
Уравнения сгорания углеводородов:
![]()
![]()
Пусть масса пропана будет х г, тогда масса бутана - (5000 – х) г.
Молярные массы алканов равны:
M(C3H8) = 36 + 8 = 44 г/моль; М(С4Н10) = 58 г/моль.
Рассчитаем
число моль веществ по формуле
![]() ,
тогда:
,
тогда:
n(C3H8) = x/44; n(C4H10) = (5000 – x)/58
Найдем общее количество углекислого газа, выделившегося в результате реакций горения алканов:
![]()
Видно, что х = 4000 г (масса пропана), следовательно, m(C4H10) = 1000 г.
Ответ: массовое соотношение газов 4 : 1.
Выведите формулу добавки к моторному топливу и укажите меры предосторожности при работе с ним, если в этом веществе 64,09 % по массе занимает четырехвалентный элемент, порядковый номер которого численно равен молярной массе диена с плотностью паров 3,661 г/л. Добавка включает предельный углеводородный радикал с долей водорода 17,24 %. (Тип № 2).
Решение: Определим четырехвалентный элемент.
Общая
формула алкадиенов - CnH2n-2.
Рассчитаем молярную массу диенов по
формуле:
![]() ,
где ρ
– плотность паров (г/л), V
= 22,4 л/моль (н.у).
,
где ρ
– плотность паров (г/л), V
= 22,4 л/моль (н.у).
Тогда М(CnH2n-2) = 3,661 г/л ∙ 22,4 л/моль = 82 г/моль.
Элемент имеет порядковый номер 82. Это свинец – Pb, находится в IV А подгруппе. Далее определим массу предельного радикала CnH2n+1. Составим пропорцию:
14n + 1 - 100 %
2n + 1 - 17,24 %
Из этой пропорции находим n = 2, т.е. R = С2Н5 – этил.
Добавка – тетраэтилсвинец (С2Н5)4Pb.
Ответ: (С2Н5)4Pb.
Свинец и его соединения - ядовитые вещества. Желательно избегать попадания бензина на кожу и уж ни в коем случае не переливать его из бака автомобиля шлангом.
