
- •Очистные агенты
- •В. И. Зварыгин
- •Часть 1
- •Глава 1 структура промывочных жидкостей
- •Структура воды
- •Структура промывочной жидкости
- •1.3. Приборы для определения прочности структуры промывочных жидкостей
- •1.4. Вязкость промывочных жидкостей
- •1.5. Приборы для замера вязкости
- •1.6. Стабильность бурового раствора
- •1.7. Водоотдача. Приборы для определения водоотдачи
- •1.8. Показатель фильтрации. Приборы для определения показателя фильтрации
- •1.9. Плотность промывочной жидкости. Приборы для определения плотности.
- •Глава 2
- •2.1. Структурообразователи
- •2.2. Структурирование глинистых растворов
- •Структурирование промывочной жидкости за счет диспергирования тердой фазы .
- •2.3. Технические средства для приготовления глинистых растворов
- •2.4. Технические средства для очистки промывочной жидкости
- •Принцип выбора и регулирования промывочнолй жидкости
- •Глава 3 полимеры и полимерные промывочные жидкости
- •3.1. Полимеры – структурообразователи
- •Состав древесины
- •3.2Свойства и функции полимеров
- •3.2. Активация полимеров
- •3.3 Свойства и функции полимеров.
- •3.4 Активация твердой фазы полимерами
- •3.5. Дезактивация дисперсной фазы гидрофобными веществами (пав, полимерами, маслами)
- •3.6 Полимерные растворы
- •3.7Технические средства для приготовления полимерных растворов
- •Глава 4 растворы электролитов
- •4.1. Общие сведения об электролитах, применяемых при бурении скважин
- •Теплота растворения электролитов
- •4.2. Электролиты в роли структурообразователя
- •4.3Роль электролитов
- •Глава 5 эмульсионные промывочные жидкости
- •5.1. Гидрофильные эмульсионные растворы
- •Эмульсионные жидкости-виброгасители
- •5.2. Гидрофобные эмульсии 2го рода
- •Параметры, характеризующие качество эибр:
- •Параметры, характеризующие качество виэр:
- •Составы и свойства тиэр
- •Оптимальные составы утяжеленных тиэр
- •Параметры, характеризующие устойчивость эмульсии, для тиэр:
- •5.3. Технические средства для приготовления эмульсионных промывочных жидкостей
- •Техническая характеристика установки уэм-5
- •Техническая характеристика установки уэм-5
- •Техническая характеристика станции пэс – 2
- •Глава 6 газообразные агенты
- •6.1. Общие понятия. Область применения. Достоинства
- •6.2. Бурение скважин с продувкой сжатым воздухом
- •Оптимальные концентрации пенообразующих пав в зависимости от минерализации пластовой воды
- •6.3. Технические средства для охлаждения и осушения воздуха
- •Техническая характеристика блока осушки завода Курганхиммаш
- •Результаты производственных испытаний осушающе-охлаждающего агрегата
- •6.4 Очистка воздуха от шлама.
- •Глава 7 газожидкостные смеси.
- •7.1 Общие сведения . Область применения
- •7.2. Параметры, характеризующие свойства гжс
- •7.3Пенообразователи . Регулирование свойств гжс
- •7.4. Технические средства получения и нагнетания газожидкостных смесей
- •Характеристики кду на базе насосов 11гр и нб4-320/63
- •Заключение
- •Часть II. Стабилизация неустойчивых стенок скважин. Задачами второй части исследований являются:
- •Глава8.Общие сведения о структуре горных пород.
- •8.1 Химические связи в минералах
- •8.2. Межмолекулярные связи в горных породах.
- •8.3 Поверхностная энергия горных пород.
- •8.4 Устойчивость горных пород стенок скважин.
- •Глава9. Промывочные жидкости для бурения уплотненных глин.
- •9.1. Уплотненные глины
- •Значения коэффициента для различной плотности глины
- •9.2. Осложнения при бурении уплотненных глин.
- •9.2.1. Механизм увлажнения и набухания глин.
- •9.2.2. Фильтрация воды в горные породы.
- •9.2.3. Разупрочнение уплотненных глин.
- •9.2.4. Диспергирование и размывание глин.
- •9.2.5. Влияние гидравлического давления на увлажнение глины.
- •9.2.6. Влияние горного давления на увлажнение глины.
- •9.3. Промывочные жидкости, применяемые для профилактики осложнений в уплотненных глинах
- •9.4. Основные направления выбора промывочной жидкости для бурения глинистых пород
- •9.5. Анализ эффективности применяющихся глинистых растворов для бурения уплотненных глин.
- •9.6. Анализ эффективности полимерных и полимерглинистых растворов.
- •9.7. Анализ эффективности ингибирующих растворов
- •Глава10. Промывочные жидкости для бурения неуплотненных глин
- •10.1. Глинистые неуплотненные породы. Осложнения при их бурении.
- •10.2. Анализ влияния электролитов на увлажнение и прочность неуплотненной глины.
- •Зависимость пластической прочности образца глины от влажности к2
- •10.3. Влияние полимеров и полимерсолевых растворов на увлажнение и прочность неуплотненных глин.
- •10.4. Полимерполисолевые промывочные жидкости, для бурения неуплотненных глин (общие понятия).
- •10.5. Исследование крепящих свойств полимерполисолевых растворов.
- •10.5.1. Теоретические рассуждения.
- •10.5.2. Экспериментальные исследования.
- •11.2. Влияние технологических параметров бурения на раскрытие трещин
- •11.3. Влияние гидродинамического давления на раскрытие трещин
- •11.4. Промывочные жидкости. Механизм их действия. Анализ эффективности.
- •Глава12. Промывочные жидкости для бурения трещиноватых горных пород.
- •12.1. Трещиноватые горные породы
- •12.2. Поглощение промывочной жидкости в трещиноватых породах
- •12.3. Мероприятия по предупреждению поглощения промывочных жидкостей
- •12.4. Анализ эффективности различных наполнителей для кольматации трещин
- •Закупоривающая способность глинистых паст
- •Определение закупоривающей способности вол
- •Закупоривающая способность вус
- •Зависимость объема тампонажной смеси от состава ее компонентов
- •12.5. Применение пен при бурении трещиноватых пород
- •Глава 13 промывочные жидкости для бурения соленосных отложений
- •13.1. Осложнения при бурении соленосных отложений
- •Растворение хемогенных горных пород Растворение горных пород в промывочной жидкости характерно для галлоидов и сульфатов, в меньшей степени карбонатов.
- •Измерение массы и длины образцов соли при растворении в воде
- •Размывание хемогенных пород
- •Зависимость скорости и константы растворения соли от скорости потока
- •13.2 Анализ влияния различных компонентов промывочной жидкости на растворяющую способность раствора
- •Скорость растворений галита в глинистом растворе, м/с10-7
- •Скорость растворения галита в перемешиваемом растворе, м/с10-7 (емкость 10л)
- •Из анализа результатов следует:
- •13.3 Промывочные жидкости, применяемые для бурения соленосных отложений
- •Промывочные жидкости, применяемые в России при бурении соленосных отложений
- •13.4 Анализ качества применяющихся промывочных жидкостей для бурения соленосных отложений
- •Скорость растворения галита в циркулирующих растворах
- •13.5 Силикатные растворы
- •Состав и свойства сульфатосиликатных и карбонатосиликатных растворов
- •13.6Лигниноглинистые растворы
- •Заключение
- •Библиографический список к первой части
- •Часть I. Теоретические основы структурирования промывочных жидкостей 2
- •Глава 1 Структура промывочных жидкостей …………………………………..2
3.7Технические средства для приготовления полимерных растворов
Для приготовления полимерных растворов применяют установку ППР (ВИТР) (см. рис. 3.5).
Установка для приготовления полимерных промывочных растворов ППР конструкции ВИТР (рис. 3.5) предназначена для приготовления полимерных растворов и растворов полимерных реагентов, для обработки бентонитовых растворов с низким содержанием твердой фазы при бурении глубоких скважин.
Раствор перемешивается в баке, установленном в водяной рубашке, снабженной нагревательными элементами. Внутри бака находится перемешивающее устройство, приводимое в действие электродвигателем. Вихревой насос типа ВКС-1/16 обеспечивает закачивание жидкости в емкость водяной рубашки, наполнение бака водой или полимерным реагентом и откачивание готового раствора. Контроль за температурой нагрева осуществляется с помощью реле.

Рис. 3.5. Установка для приготовления полимерных растворов ППР (ВИТР).
1 – температурное реле; 2 – нагревательные элементы; 3 – перемешивающее устройство; 4 – водяная рубашка; 5 – бак для перемешивания растворов; 6 – загрузочное устройство; 7 – электродвигатель; 8 – термометр; 9 – пульт управления; 10 – шкаф управления; 11 – штекерный разъем; 12 – вихревой насос с электродвигателем; 13 – болт заземления.
Глава 4 растворы электролитов
4.1. Общие сведения об электролитах, применяемых при бурении скважин
К электролитам относят щелочи, кислоты, соли, легко диссоциирующие в воде на ионы, вследствие высокой их гидрофильности и слабой связи между ионами.
Щелочи - хорошо растворимые в воде основания. Чаще это соединения одновалентных металлов с гидроксиланионами:
Na – O – H K – O – H.
В качестве катионов электролитов-щелочей выступают одновалентные и двухвалентные металлы с большим ионным радиусом, например, Ва (ОН)2 (ионный радиус Ва2+ 1,43 А°).
Основания двухвалентных металлов с малыми ионными радиусами в воде малорастворимы, например, Са(ОН)2 (ионный радиус Са 1,06 А°), или нерастворимы, например, Мg(ОН)2 (ионный радиус Мg 0,78 А°).
Кислоты - это химические соединения, диссоциирующие в воде с образованием в качестве катионов ионов водорода. К сильным кислотам относят кислоты со слабыми связями водорода с высокоотрицательными анионами: Cl, Вг, I, и кислородсодержащими анионными группами (при наличии в них не менее, двух атомов кислорода с двойными связями).
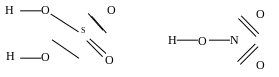
S
Вследствие
малых ионных радиусов металлоиды (S-
0,35 А0
, Р- 0,35 А°, N - 0,2 А°, С - 0,2 А°) с атомами
кислорода образуют прочные связи (S–О
517 кДж/моль, Р-О 594 кДж/моль, С-О 1071 кДж/моль).
Связи водорода с кислородсодержащими
анионными группами ослаблены вследствие
высокой электроотрицательности кислорода
(для кислорода она равна Э = 3,5, для серы
Э = 2,5, фосфора Э = 2,1 , азота Э =
3,0 , углерода Э = 2,5). Электронное облако
в результате этого смещается в сторону
несвязанного водородом кислорода. Связь
металлоида с кислородом становится
полярной. На полюсе металлоида
положительный, на полюсе кислорода -
отрицательный заряд. Электронное облако
кислорода, связанного с водородом, в
свою очередь смещается в сторону
металлоида, а прочность связи водорода
с кислородом понижается.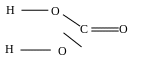
Чем больше атомов кислорода с двойной связью, выше полярность аниона, тем ниже прочность связей водорода с анионной группой. Так, сильные кислородсодержащие кислоты имеют не менее двух таких атомов: H2S04, НNОз, НМnO4 и т.д.
Эффективность электролита определяется количеством ионов, появившихся в растворе при его диссоциации. Наиболее полно диссоциируют кислоты с одновалентными анионами (галогенами). Причем с увеличением ионного радиуса галогена прочность связей ионов понижается, степень диссоциации повышается.
Степень диссоциации в химии обычно определяют по константе диссоциации
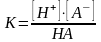 ,
,
где в числителе указаны концентрации ионов (продуктов диссоциации), а в знаменателе - концентрация недиссоциированных молекул.
Соли-электролиты - это соли со слабыми связями гидрофильных ионов (соли сильных кислот и соли слабых кислот одновалентных металлов). Их можно разделить на три группы: щелочные, кислотные и нейтральные.
К кислотным солям относят соли поливалентных металлов, после диссоциации активно взаимодействующих с молекулами воды и образующих в результате гидролиза ионы водорода Н+, например,
А1С1з=А13+ +ЗСl-
Al3++H2O=Al(OH)2++H+
Al(OH)2++ H2O= Al(OH)++H+
Al(OH)++ H2O = А1(ОН)3 + H+
К "нейтральным" солям относят соли, диссоциирующие на ионы, слабо взаимодействующие с молекулами воды, соли с одновалентными анионами (галоиды): NaCI, КСl, CaC12 и др.
К щелочным солям относят соли слабых кислот чаще одновалентных металлов с поливалентными анионами, способными образовывать (после диссоциации) в растворе связи с водородом воды и ионы ОН- : карбонаты, нитраты фосфаты и др.
Na2CО3+Н2О=2Nа+НСО3+ +ОН-
Свойства полимеров. Растворимость (диссоциация) соли зависит от прочности связей анионов с катионами и их гидрофильности. Хорошо растворяются соли со слабыми связями одновалентных катионов с различными анионами. Значительно труднее растворяются соли, образованные двухвалентными анионами и катионами. Существенно влияет на растовримость соли их гидрофильность.
Гидрофильность электролитов можно определить по теплоте их растворения (табл.4.1).
Таблица 4.1
