
Лабораторные работы / 1-Лабораторная_Химия_2
.RTFПриборы и реактивы
Калориметр, технические весы , пробирки , штатив для пробирок, химические стаканы, дистиллированная вода, двумолярный (2 М) раствор едкого натра , одно-молярный раствор (I М) серной кислоты H2SO4.
Указания к лабораторной работе
Опыты по определению энтальпии химических реакций проводятся в калориметрах различной конструкции. В лабораториях используется простейший калориметр, который состоит из наружного стакана 1 емкостью 500 мл, изотермической крышки 6 наружного стакана , внутреннего сосуда 2 емкостью 250 мл , который сверху закрывается изотермической крышкой 5 с тремя отверстиями : для стеклянной мешалки 4 , термометра 3 с ценой деления 0,1 °С и пробирки 7 (если пробирка для работы не нужна , то отверстие закрывается пробкой) . В отверстие для пробирки , когда нужно , может вставляться воронка .
Опыт 1.
Нейтрализация серной кислоты едким натром в две стадии. Проводить опыт в следующем порядке:
1) в калориметр отмерить 50 мл одномолярного раствора серной кислоты Н2S04;
2)
t1
= ;
;
3) быстро вливаем в кислоту 25 мл двумолярного раствора щелочи NaOH из сосуда и осторожно перемешиваем полученный раствор кислой соли NаHS04 (объем V1);
4)
t2=
H2SO4
+ NaOH = NaНSO4
+ H2O
DH1
=
 40,90
(1)
40,90
(1)
где DH1 - теплота реакции;
5) Dt1 = t2 – t1=31,968-22=9,968 и объем V1=75 мл;
6)
к полученному раствору NaНSO4
быстро прилить оставшиеся 25 мл раствора
щелочи, t3= .
В данном случае кислая соль превращается
в среднюю по реакции NaHSO4
+ NaOH
= Na2SO4
+ H2O
DH2
=
.
В данном случае кислая соль превращается
в среднюю по реакции NaHSO4
+ NaOH
= Na2SO4
+ H2O
DH2
= 16,97 (1)
16,97 (1)
где DH2 - теплота реакции;
7)
определить разность температур Dt2
= t3
– t2= и объем V2=88,75
мл;
и объем V2=88,75
мл;
8) результаты опыта занести в табл. 1;
Таблица 1
________________________________________________________________
| Объем раствора, мл | Разность | Плотность | Теплоемкость | Наблюдаемая |
|__________________|темпера- | раствора, | Дж/(г.К) | теплота, |
| H2SO4 | NaOH | тур, С | г/моль | | кДж/моль |
|________________________________________________________________|
| 50 | 25 | 22 | 1.09 (V1) | 5.02 (V1) | 40,90 |
| | 25 | 31,968 | 1.12 (V2) | 6.28 (V) | 16,97 |
|________________________________________________________________|
Опыт 2.
Нейтрализация серной кислоты едким натром одну стадию. Проводить опыт в следующем порядке:
1) в калориметр отмерить 50 мл одномолярного раствора серной кислоты Н2S04;
2)
t4=
3) быстро (и без потерь) влить в кислоту 50 мл двумолярного раствора щелочи NaOH из сосуда и осторожно перемешать полученный раствор средней соли Nа2S04;
4)
t5= ,
,
H2SO4 + 2 NaOH = Na2SO4 + 2 H2O : DH3 (3)
где DH3 - теплота реакции;
5)
Dt3
= t5
– t4= и объем V3
=88,75
и объем V3
=88,75
6) результаты опыта занести в табл. 2;
Таблица 2 ________________________________________________________________
| Объем раствора, мл | Разность | Плотность | Теплоемкость | Наблюдаемая |
|__________________|темпера- | раствора, | Дж/(г.К) | теплота, |
| H2SO4 | NaOH | тур, С | г/моль | | кДж/моль |
|________________________________________________________________|
| 50 | 50 | 8,64 | 1.12 | C3 = 6.28 | 53,93 |
|________________________________________________________________|
9) вычислить энтальпию (DH1, DH2, DH3) реакции нейтрализации по формуле:
DH = V * d * C * Dt * 10 * 0.001,
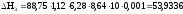
10) DH1 + DH2 =57,87;
11) сравнить значение суммарной теплоты реакции DH1 + DH2 со значением DH3 и сделать соответствующие выводы;
DH1 + DH2 > DH3
57.8>53.93
Энтальпия первого опыта больше чем энтальпия второго, следовательно в первом случае химическая реакция протекла быстрее.
12) вычислить абсолютную и относительную ошибки определения теплоты реакции (3);
13) записать уравнение реакции (1, 2 и 3) в виде термохимических уравнений.
H2SO4(ж) + NaOH(ж) = NaНSO4 + H2O(ж) +40,90 кДж (Q) (реакция экзотермическая)
NaHSO4(ж) + NaOH(ж) = Na2SO4(ж) + H2O(ж) +16,97 кДж (Q) (реакция экзотермическая)
H2SO4(ж) + 2 NaOH(ж) = Na2SO4(ж) + 2 H2O(ж) +53,93 кДж(Q) (реакция экзотермическая)
