
1 Контрольная работа / 1-10_Химия
.rtfТомский университет систем управления и радиоэлектроники.
Контрольная работа по химии №1.
Вариант 4.10
Выполнил:
студент гр.
факультет ЭТ
Автор уч. пос.
Смирнов Г.В. и Якунина Г.М.
2002г.
1. Написать формулы оксидов, соответстыующих гидроксидам: H2SiO; H4SiO4; H3AsO4; HAsO3; Cu(OH)2; Zn(OH)2. Какими свойствами (основными, амфотерными, кислотными) обладают оксиды и соответствующие им гидроксиды. Назвать и построить их графические формулы. Определить эквивалент и эквивалентную массу для соединений: CuO; Cu(OH)2; Al2O3; H3AsO4; Al2(SO4)3.
Решение:
H2SiO – SiO2 – кислотные свойства;
H4SiO4 – SiO2 – кислотные свойства;
H3AsO4 – As2O5 - кислотные свойства;
HAsO3 - As2O5 - кислотные свойства;
Cu(OH)2 – CuO – основные свойства;
Zn(OH)2 – ZnO - основные свойства.
H2SiO – метакремнивая кислота
H
– O
SiO=O
H – O
SiO2 - диоксид кремния (IV) или диоксид кремния
O = Si = O
H4SiO4 – ортокремниевая кислота
H
– O O – H

SiO
H
– O O – H
H3AsO4 – ортомышьяковая кислота
H
– O
H
– O
–
As=O
H – O
As2O5 – оксид мышьяка (V)
O
As
= O O
= As = O

O или O
As
= O O
= As = O
O
HAsO3 – метамышьяковая кислота
H
– O – As = O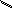
O
Cu(OH)2 – гидроксид меди (II), CuO – оксид меди (II)
H
– O
Cu Cu = O
H – O
ZN(OH)2 – гидроксид цинка, ZnO – оксид цинка
H
– O
Zn Zn = O
H – O
ЭCuO
=
 ;
;
ЭCu(OH)2
=
 ;
;
ЭAl2O3
=
 ;
;
ЭH3AsO4
=
 ;
;
ЭAl2(SO4)3
=
 .
.
-
Закончить уравнения реакций, какие из приведенных реакций можно использовать в технологии получения плёнок (каких)? Составить ионные уравнения (где возможно).
Решение:
-
Ca+As = Ca+3As-3;
-
Si+O2 = Si+4O2-2;
-
4Al+3O2 = 2Al2+3O3-2;
-
2Na+O2 = Na2+1O2-1;
-
SiO2+4HF = SiF4+2H20;
-
Zn(OH)2+2NaOH = Na2ZnO2+2H20,
Zn(OH)2+2Na+ + 2OH–= 2Na++ZnO22–+2H20,
Zn(OH)2+2OH– = ZnO22–+2H20;
-
Zn(OH)2+H2SO4 = ZnSO4+2H20,
Zn(OH)2+2H++SO4–2 = Zn2+SO42–+2H20,
Zn(OH)2+2H+ = Zn2++2H2O;
-
SiCl4+6NH3 = [Si(NH3)6]Cl4,
Si4++4Cl–+6NH3 = [Si(NH3)6]4++4Cl–,
Si4++6NH3 = [Si(NH3)6]4+;
-
H3PO4+3NaOH = Na3PO4+3H2O,
H3PO4+3Na++3OH– = 3Na++PO43–+3H2O,
H3PO4+3OH– = PO43–+3H2O.
В получении плёнок можно использовать реакцию получения оксида алюминия Al2O3. Образование этой оксидной плёнки тормозит процесс коррозии металла. Возможно в получении плёнок использовать реакцию получения арсенида галия GaAs.
-
Вычислить изменение энтальпии ΔHo в процессе превращения деметилового эфира в этиловый спирт:
CH3OCH3(r) = CH3CH2OH(ж)
Если:
CH3OCH3(r) +3O2=2CO2+3H2O(r); ΔHo = –1454 кДж;
CH3CH2OH(r)+3O2=2CO2+3H2O(r); ΔHo = –1402 кДж;
Какое вество эфир или спирт более устойчиво? Почему не происходит самопроизвольного превращения одного вещества в другое.
Решение:
Чтобы получить заданное уравнние реакции, необходимо из 1–го уранения вычисть 2–ое уравнение.
CH3OCH3(r) +3O2 – CH3CH2OH(r) –3O2 = 2CO2 + 3H2O(r) –2CO2 –3H2O(r)
Получаем после преобразований заданное уравнение:
CH3OCH3(r) = CH3CH2OH(ж)
Измение энтальпии ΔHo в этом превращении равно :
ΔHo = ΔHo1 – ΔHo2 =–1452 – (–1402)= –50кДж.
Превращение эфира в спирт – процесс экзотермический, то есть идёт с выделением тепла, значит спирт более устоичивое соединение.
-
Какое количество теплоты выделится при превращении 1 кг красного фосфора в чёрный, если при сгорании красного и чёрного фосфора образуется P2O5 и выделится, соответственно, тепло:
ΔHo (Pкрасн)=–18,41 кДж/моль;
ΔHo (Pчёрн)=–43,2 кДж/моль.
Решение:
В условии задачи даны энтальпии сгорания красного и чёрного фосфора, значит тепловой эффект реакции красного фосфора в чёрный будет равен:
ΔHo = ΔHo (Pчёрн) – ΔHo (Pкрасн) = –43,2 – (–18,41) = –24,79 кДж.
По уравнению реакции 1 моль атомов красного фосфора превращается в чёрный фосфор, при этом выделяетяс 24,79 кДж теплоты.
1 моль P составляет 31г.
31г P – 24,79 кДж
1000г P – x кДж.
 кДж
кДж
При превращении 1кг красного фосфора в чёрный выделяется 799,6 кДж теплоты.
-
Реакция протекает по уравнению 2SO2+O22SO3. Вычислить константу равновесия и исходные концентрации сернистого газа и кислорода, если концентрация всех веществ в момент равновесия были равны: [SO2] =5 моль/л, [O2]=1,3 моль/л, [SO3]=4 моль/л.
Решение:
2SO2 +O22SO3
Кс
=

Исходные концентрации SO2 и O2 находим на основе уравнения реакции, согласно которому из 2–х молекул SO2 и одной молекулы O2 образуются две молекулы SO3. Отсюда следует, что на образование 4–х молекул SO3 расходуется 4 молекулы SO2 и 2 молекулы O2. Таким образом, исходные концетрации веществ SO2 и O2 равны:
[SO2]исх = 4+5=9 моль/л;
[O2]исх =2+1,3 =3,3 моль/л.
-
Написать уравнение закона действия масс для следующих реакции:
-
2H2+O2=2H2O(ж); ΔHo = –573,2 кДж;
-
N2+O2=2NO; ΔHo = –180,8 кДж;
-
C(T)+H2O(r)=CO+H2; ΔHo = –131,3 кДж;
Как изменится скорость вышеупомянутых реакций, если давление в системе увеличится в два раза? В каком направлении сместится равновесие? Будет ли влиять изменение температуры на смещение равновесие?
Решение:
Закон действия масс: скорость реакции прямопропорциональна произведению концентрации реагирующих веществ.
2H2+O2=2H2O(ж) ΔHo = –573,2 кДж
V
=
 ;
;
N2+O2=2NO ΔHo = –180,8 кДж
V
= ;
;
C(T)+H2O(r)=CO+H2 ΔHo = –131,3 кДж
V
= ;
;
Твёрдая фаза (Ст) в выражениях закона действия масс не входит.
При увеличении давления в два раза, концентрация реагирующих веществ увеличивается в 2 раза, значит, и скорость реакции увеличивается:
V1=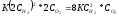 ,
то есть скорость увеличится в 8 раз
,
то есть скорость увеличится в 8 раз
 ;
;
V1= ,
Скорость реакции увеличится в 4 раза.
,
Скорость реакции увеличится в 4 раза.
 ;
;
V1= ,
Скорость реакции увеличится в 2 раза.
,
Скорость реакции увеличится в 2 раза.
 .
.
Равновесие сместится в сторону образования меньшего числа газообразующих веществ. В 1–ой реакции равновесие сместится вправо, во 2–ой реакции равновесие смещатся не будет, т.к. число молей газообразных веществ в правой и левой частях уравнения одинаковое. В 3–ей реакции равновесие будет смещаться влево.
Изменение температуры будет влиять на смещение равновесия, так как все три реакции соправождаются изменением энтальпии ΔHo.
