
- •Томский государственный университет систем управления и радиоэлектроники
- •3. Вычислите изменение энергии Гиббса g при 25с для реакции между чистыми веществами:
- •4. Вычислите тепловой эффект реакции:
- •6. Температурный коэффициент скорости некоторой реакции 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на двадцать пять градусов.
- •7. На основании характерных точек кривых охлаждения построить диаграмму системы медь-никель (Cu-Ni).
- •8. При 500 – 600 c в системе, состоящей из железа, его оксидов и кислорода, возможно существование равновесий:
4. Вычислите тепловой эффект реакции:
![]()
исходя из тепловых эффектов следующих реакций:
![]() ;
; ![]() =
-212, 55 кДж;
=
-212, 55 кДж;
![]() ;
; ![]() = -156,94 кДж
= -156,94 кДж
Решение:
Для получения заданного уравнения необходимо сложить первое уравнение умноженное на 3/4 и второе уравнение умноженное на 1/4. Соответственно, согласно закону Гесса, требуется сложить и теплоты реакций:
![]() ;
;
![]()
 ;
;
![]() ;
;
![]() =
=
![]() =
- (3212,55
+ 156,94) /4 = -198, 65 кДж (реакция экзотермическая).
=
- (3212,55
+ 156,94) /4 = -198, 65 кДж (реакция экзотермическая).
5. Написать уравнение закона действия масс для следующих обратимых процессов:
1)
![]() ;
;![]() = -112,96 кДж;
= -112,96 кДж;
2)
![]() ;
;![]() = -92,38 кДж;
= -92,38 кДж;
3)
![]() ;
;![]() = -483,58 кДж
= -483,58 кДж
Как изменится скорость прямого и обратного процессов при увеличении давления в два раза? Будет ли наблюдаться смещение равновесия, в каком направлении?
Решение
константа равновесия выразится:
1)
![]() +
112,96 кДж;
+
112,96 кДж;
 ;
;
2)
![]() +
92,38 кДж;
+
92,38 кДж;
 ;
;
3)
![]() +
483,58 кДж
+
483,58 кДж
 .
.
При увеличении давления в 2 раза, согласно принципу Ле Шателье, равновесие в системе сместится в сторону продуктов реакции, т.к. уменьшается число молей газообразных веществ и соответственно, давление в системе во всех трех реакциях. Наоборот, уменьшение давления будет способствовать течению обратной реакции.
6. Температурный коэффициент скорости некоторой реакции 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на двадцать пять градусов.
Решение
В соответствии с правилом Вант-Гоффа:
![]() ,
,
где
![]() и
и![]() - скорости химической реакции при
- скорости химической реакции при![]() и
и![]() ;
;![]() -
-![]() =
25,
=
25,
![]() = 2,3.
= 2,3.
![]() ;
;
 .
.
Ответ: Скорость реакции увеличится в 8 раз.
7. На основании характерных точек кривых охлаждения построить диаграмму системы медь-никель (Cu-Ni).
|
Cu, вес % |
0 |
20 |
40 |
60 |
80 |
100 |
|
Т-ра начала кристаллизации, К |
1373 |
1467 |
1554 |
1627 |
1683 |
1728 |
|
Т-ра конца кристаллизации, К |
1373 |
1406 |
1467 |
1543 |
1629 |
1728 |
а) определить тип диаграммы и ее особенности;
б) определить число компонентов, число фаз и число степеней свободы в каждой из областей, ограниченных линиями диаграммы, на линиях и точках (по Вашему выбору). Что значит число степеней свободы?
в) построить кривые охлаждения для расплавов, содержащих 0, 40 и 100% никеля. Что понимается под твердым раствором? Типы твердых растворов.
Решение
построим кривые охлаждения для расплавов, содержащих 0, 20,40, 60 и 100% меди.
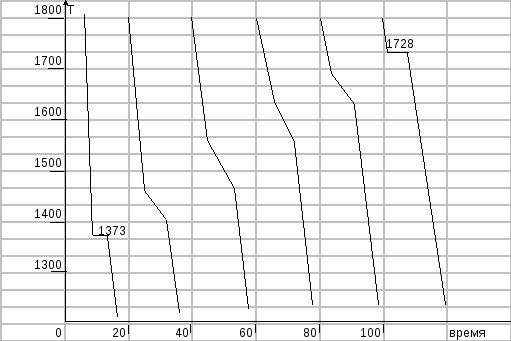
а) Тип диаграммы – это диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии.
Особенностью этой диаграммы является отсутствие эвклетики. Вид кривых плавления обусловлен тем, что при охлаждении расплава кристаллы всегда содержат оба компонента, кроме кристаллизации чистого никеля или чистой меди.

б) определить число компонентов, число фаз и число степеней свободы в каждой из областей, ограниченных линиями диаграммы, на линиях и точках (по Вашему выбору). Что значит число степеней свободы?
В диаграмме различимы три области (I, II, III).
Первая область – это ненасыщенный расплав; фаз – 1, число степеней свободы – 2, число компонентов – 2.
Вторая область – представляет собой систему твердых и жидких растворов, т.е. каждой температуре соответствуют определенные жидкие и твердые растворы. Фаз -2, число степеней свободы – 1, число компонентов – 2.
Третья область – система представляет собой твердый раствор меди и никеля. Фаз – 1, число степеней свободы – 2, число компонентов – 2.
Возьмем фигуративную т.М в области II, которая состоит из расплава Ni – Cu и кристаллов Ni – Cu. Расплав соответствует т.С (Ni – 32%, Cu – 68%); а состав кристаллов т.В (Ni – 20%, Cu – 80%).
Под числом степеней свободы понимается число термодинамических параметров (температура, давление, концентрации компонентов), определяющих состояние системы, которые можно произвольно изменять (независимо один от другого) без изменения числа фаз в системе.
При одновременной кристаллизации двух компонентов в бинарной системе число степеней свободы равно нулю:
К = 2; Ф = 3 (две твердых и одна жидкая фаза). С = К + 1 – Ф = 2 + 1 – 3 =0.
в) построить кривые охлаждения для расплавов, содержащих 0, 40 и 100% никеля.
|
Ni, вес % |
0 |
40 |
100 |
|
Т-ра начала кристаллизации, К |
1728 |
1627 |
1373 |
|
Т-ра конца кристаллизации, К |
1728 |
1543 |
1373 |
I II III
Твердые растворы можно определить как фазы переменного состава, находящиеся в состоянии химического (термодинамического) равновесия. Существует 3 типа твердых растворов:
твердые растворы замещения (NaCl, KCl), которые возникают в результате статистического замещения одних атомов другими в узлах кристаллической решетки;
твердые растворы внедрения, образующиеся в результате встраивания атомов растворимого вещества в междоузлия кристаллической решетки растворителя (Me + H, B, C и др.);
твердые растворы, образованные только на основе хим.соединений при недостатке одного из компонентов в соответствующей подрешетке (TiO).

