
- •Томский государственный университет систем управления и радиоэлектроники
- •3. Вычислите изменение энергии Гиббса g при 25с для реакции между чистыми веществами:
- •4. Вычислите тепловой эффект реакции:
- •6. Температурный коэффициент скорости некоторой реакции 2,3. Во сколько раз увеличится скорость этой реакции, если повысить температуру на двадцать пять градусов.
- •7. На основании характерных точек кривых охлаждения построить диаграмму системы медь-никель (Cu-Ni).
- •8. При 500 – 600 c в системе, состоящей из железа, его оксидов и кислорода, возможно существование равновесий:
Томский государственный университет систем управления и радиоэлектроники
/ТУСУР/
Контрольная работа №1
по химии
вариант 7
студентки 2 курса
специальности 060800
«Экономика и управление
на предприятиях» заочной
формы обучения
Закончить уравнения реакций:
1)
![]() 6)
6)![]()
2)
![]() 7)
7)![]()
3)
![]() 8)
8)![]()
4)
![]() 9)
9)![]()
5)
![]() 10)
10)![]()
Какие из приведенных реакций можно использовать в технологии получения пленок (каких)? Составить ионные уравнения реакций (где возможно).
Решение:
1)
![]()
Полное ионное уравнение реакции:
![]()
Сокращенное ионное уравнение реакции:
![]()
2)
![]()
3)
![]()
4)
![]()
Полное ионное уравнение реакции:
![]()
Сокращенное ионное уравнение реакции:
![]() (вода
малодиссоциирующее вещество)
(вода
малодиссоциирующее вещество)
5)
![]()
6)
![]()
7)
![]()
Полное ионное уравнение реакции:
![]()
Сокращенное ионное уравнение реакции:
![]()
8)
![]()
9)
![]()
10)
![]()
Реакции (2), (6) образования оксида свинца можно использовать для получения противокоррозионной пленки.
Составить уравнения получения возможных солей между угольной кислотой и гидроксидом марганца(III). Назвать все соли и построить их графические формулы.
Решение:
Составляем возможные кислотные и основные остатки и формулы солей.
Учитывая остатки, находим, что, возможно, получить две основные, одну кислую и одну нормальную соли. Стрелками показаны возможные сочетания взаимодействующих остатков с образованием соответствующих солей.
|
Основные остатки |
Кислотные остатки |
Формулы солей |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
![]()
![]() -
карбонат дигидроксомарганца
-
карбонат дигидроксомарганца
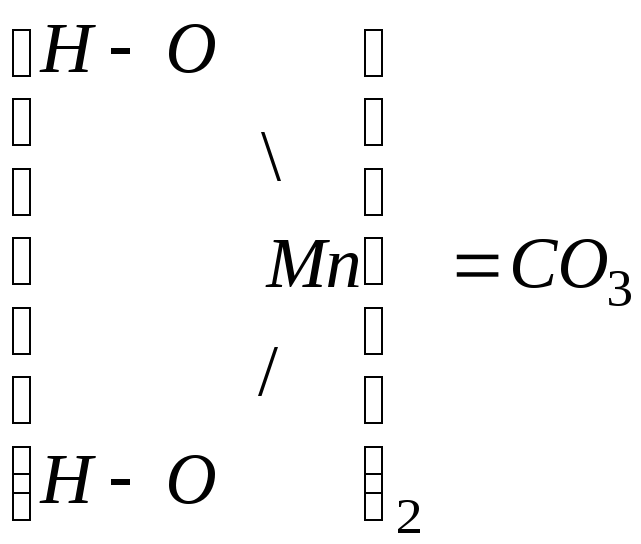
![]()
![]() -
карбонат гидроксомарганца
-
карбонат гидроксомарганца
![]()
![]()
![]() -
гидрокарбонат марганца
-
гидрокарбонат марганца

![]()
![]() -
карбонат марганца
-
карбонат марганца
![]()
3. Вычислите изменение энергии Гиббса g при 25с для реакции между чистыми веществами:
![]()
по стандартным значениям энтальпий образования и абсолютных энтропий химических веществ:
![]() =
-46,19 кДж/моль;
=
-46,19 кДж/моль; ![]() = 192,50 Дж/(мольК);
= 192,50 Дж/(мольК);
![]() =
0;
=
0; ![]() = 205,03 Дж/(мольК);
= 205,03 Дж/(мольК);
![]() =
-241,84 кДж/моль;
=
-241,84 кДж/моль; ![]() = 188,74 Дж/(мольК);
= 188,74 Дж/(мольК);
![]() =
90,37 кДж/моль;
=
90,37 кДж/моль; ![]() = 210,62 Дж/(мольК).
= 210,62 Дж/(мольК).
В каком направлении (прямом или обратном) наиболее вероятен процесс?
Можно ли изменить его направление при изменении температуры до 500С? Покажите расчетом.
Какова роль энтропийного и энтальпийного факторов?
Решение
Находим изменение энтальпии и энтропии для реакции при стандартных условиях:
![]() =
[6
=
[6![]() +
4
+
4![]() ]
- [4
]
- [4![]() + 5
+ 5![]() ]
=
]
=
= [6(-241,84) + 490,37] - [4(-46,19)+50] = -1089,56 + 184,76 = - 904,8 кДж.
![]() =
[6
=
[6![]() +
4
+
4![]() ]
- [4
]
- [4![]() + 5
+ 5![]() ]
=
]
=
= [6188,74 + 4210,62] - [4192,50+5205,03] = 1974,92 - 1795,15 = 179,77 Дж.
Зависимость энергии Гиббса для данной реакции описывается уравнением:
![]()
При стандартной температуре:
![]() =
-904,8 - 298179,1510-3
= -958,2 кДж
=
-904,8 - 298179,1510-3
= -958,2 кДж
При температуре 500С (773K):
![]() =
-904,8 - 773179,1510-3
= -1043,3 кДж
=
-904,8 - 773179,1510-3
= -1043,3 кДж
Отрицательное значение энергии Гиббса указывает на то, что наиболее вероятно протекание процесса в прямом направлении.
Более
отрицательное значение
![]() по сравнению с
по сравнению с![]() свидетельствует о том, что при 773К
равновесие реакции еще в большей степени
вправо - в сторону образованияNO.
Следовательно при увеличении температуры
до 500С
направление реакции не изменится.
свидетельствует о том, что при 773К
равновесие реакции еще в большей степени
вправо - в сторону образованияNO.
Следовательно при увеличении температуры
до 500С
направление реакции не изменится.
Отрицательное значение энтальпии свидетельствует о том, что реакция протекает с выделением тепла.
Положительное значение изменения энтропии S говорит о том, что реакция может протекать самопроизвольно при постоянной температуре.




