
1 Контрольная работа / 1- 4_Химия
.DOC
Томский межвузовский центр дистанционного образования
Томский государственный университет
систем управления и радиоэлектроники (ТУСУР)
Контрольная работа № 1
по дисциплине «Химия»
вариант№4
Выполнил:
студент ТМЦДО
гр.: …….
Специальности.……
………………….
……………….. 2…. г.
г. ……………
…..г
-
Написать формулы оксидов, соответствующих указанным гидроксидам: Sn(OH)4; Sn(OH)2; H3VO4; HVO3; Ni(OH)2; Ni(OH)3; H4SiO4. Какими свойствами (основными, амфотерными, кислотными) обладают оксиды и гидроксиды? Назвать и построить их графические формулы. Определить эквивалент и эквивалентную массу для соединений: NiO; Ni(OH)2; Ni(SO4)3; H4SiO4.
SnO 2-основной оксид олова (IV) O=Sn=O
SnO- основной оксид олова (II) Sn=O
V2O5-амфотерный
оксид ванадия (V)
O=V-![]() O-V=O
O-V=O
V2O5-амфотерный
оксид ванадия(V)
![]()
![]()
NiO- основной оксид никеля(II) Ni=O
Ni2O3- основной оксид никеля(III) O=Ni-O-Ni=O
SiO2-кислотный оксид кремния(IV) O=Si=O
|
вещество |
э |
м/э |
|
|
NiO |
2 моль |
37,3 г |
Ni = O |
|
Ni(OH)2 |
2 моль |
46,5 г |
H-O-Ni-O-H |
|
Ni2(SO4)3 |
6 моль |
67,6 г |
О О О О О \ \ / \ // / \ / / S Ni – O – S – O – Ni S / / \ / \\ \ / \\ O O O O O |
|
H4SiO4 |
4 моль |
24 г |
H-O O-H \ / Si / \ H-O O-H |
-
Закончить уравнения реакций:
SnO+K2O=;
Sn (OH)4+H2SO4=;
SnH4![]() ;
;
SnO+HCl=;
![]() 2SO4+H2SO4=;
GaCl3+NH3=;
2SO4+H2SO4=;
GaCl3+NH3=;
Sn(OH)2+KOH=; SnH4+O2=; SnCl2+NaOH=; P+O2=.
Какие реакции можно использовать в технологии получения плёнок (каких)?
Составить ионные уравнения реакций (где возможно).
SnO+K2O= K2SnO2
SnO+2HCl= SnCl2 + Н2О
Sn
(OH)2+2KOH=
K2![]()
Sn(OH)4+2H2SO4=Sn(SO4)2+4H2O
Sn4++4OH-+4H++2SO42-=Sn4++2SO4-2+4H2O
![]() 2SO4+H2SO4=2CuSO4+2H2O
2SO4+H2SO4=2CuSO4+2H2O
2Cu(OH)++SO42-+2H++SO42-=2Cu2++2SO42-+2H2O
SnH4+O2=
Sn (OH)2![]() +H2
+H2
SnH4![]() Sn
Sn![]() +2H2
+2H2![]()
GaCl3+NH3
(конц.)=![]() Ga(ОH)3+NН4Cl
Ga(ОH)3+NН4Cl
GaCl3+NH3
=![]() (NН4)3
[Ga(OH)6]
(NН4)3
[Ga(OH)6]
SnCl2+2NaOH=Sn
(OH)2![]() +2NaCl
+2NaCl
P+O2=P2O5
-
Вычислить изменение энергии Гиббса химической реакции:
Cd(T)+2AgCl(T)=2Ag(T)+CdCl2(T)
при
![]() С
по стандартным значениям энтальпий
образования и абсолютных энтропий.
Реакция проводится между чистыми
веществами:
С
по стандартным значениям энтальпий
образования и абсолютных энтропий.
Реакция проводится между чистыми
веществами:
![]() ;
;
![]() =56,76
Дж/(моль.
К);
=56,76
Дж/(моль.
К);
![]() (AgClT)=-126,8
кДж/моль;
(AgClT)=-126,8
кДж/моль;
![]() =96,97
Дж/(моль.
К);
=96,97
Дж/(моль.
К);
![]() (AgT)=0;
(AgT)=0;
![]() =42,9Дж/(моль.
К);
=42,9Дж/(моль.
К);
![]() (CdCl2T)=-389,0
кДж/моль;
(CdCl2T)=-389,0
кДж/моль;
![]() =115,2
Дж/(моль.
К);
=115,2
Дж/(моль.
К);
На основании вычисленной энергии Гиббса сделать вывод о возможности реакции. Возможен ли обратный процесс этой реакции? Что об этом говорят энтальпийный энтропийный факторы?
![]() Сd(T)+2AgCl(T)=2Ag(T)+CdCl2(T)
Сd(T)+2AgCl(T)=2Ag(T)+CdCl2(T)
T=![]() C=298K
C=298K
![]() =
=![]()
![]() =2ΔHAg+ΔHCdCl2-2ΔHAgCl-ΔHCd=2*0+*(-389.0)-2*
=2ΔHAg+ΔHCdCl2-2ΔHAgCl-ΔHCd=2*0+*(-389.0)-2*
(-126.8)_-0=-135,4![]()
ΔS=![]() Sпр-
Sпр-![]() nΔSисх=2*42,
9+*115, 2-2*96, 97-56, 76=85, 8+115,2-193, 94-56, 76=-49,7
nΔSисх=2*42,
9+*115, 2-2*96, 97-56, 76=85, 8+115,2-193, 94-56, 76=-49,7![]()
ΔG=ΔH-TΔS=-135400-298(-49,7)=-12058,9![]()
Так как ΔG реакция при обычных условиях идёт с увеличением количества продуктов. Обратная реакция при этих же условиях не возможна. В результате реакции выделяется теплота и увеличивается мера беспорядка системы.
-
Определить количество теплоты, которое нужно затратить для нагревания 10г водорода при постоянном давлении и постоянном объеме от 25 до 500
 С,
если истинная молярная теплоёмкость
равна:
С,
если истинная молярная теплоёмкость
равна:
Ср=27,28+3,26*10-3*T+0.502*105*T-2 Дж/(моль. К)
Расчеты количества
теплоты произвести через значения
истинной и средней теплоёмкости (Ср,Cv
и
![]() ),
сравните результаты и сделайте выводы.
),
сравните результаты и сделайте выводы.
Ср=27,28+3,26*10-3*T+0.502*105*T-2 Дж/моль.К
T1=298K T2=773K
Cр=27,28+(3,26*10-3)/2*(T2+T1)+(0.502*105)/(-1) *(T2+T1)-2=27.28+1.63*10-3*
*(T2+T1)-0.502*105*![]() =27.28+1.63*10-3*(298+773)-0.502*105*
=27.28+1.63*10-3*(298+773)-0.502*105*
(1/(7732+773*298+2982))=27.28+1.746-0.502*105*(1/(597529+230354+88804))=
=29.026-![]() =29.026-0.0547=28.9713
=29.026-0.0547=28.9713![]()
1.Qp=![]() =(10/2)*28.971*(773-298)=5*28.97*475=68.8кДж
=(10/2)*28.971*(773-298)=5*28.97*475=68.8кДж
2.
QpnCpdT=n![]() =n(27.28(T2-T1)+
=n(27.28(T2-T1)+![]() *(
*(![]() )+0.502*105*
)+0.502*105*![]() )=
)=
=5*(27.28*(773-298)+1.03*10-3*(597529-88804)+0.502*105*![]() =
=
=5*(12958+829.2+103.5)=69.5кДж
Qp1=68.8кДж Qp2=69.5кДж
ΔQp=( Qp2- Qp1)=0.7кДж значения Qp практически равны.
3. Qv=n![]()
![]()
![]() =28.97-8.314=20.66Дж/(моль.К)
=28.97-8.314=20.66Дж/(моль.К)
Qv=![]() *20.66*(773-298)=49кДж
*20.66*(773-298)=49кДж
4.Сp/Cv=![]() =1.40
=1.40
Cv=![]() =49.6кДж
=49.6кДж
Qp>Qv т.е. при постоянном объеме нагрев расходуется меньше количества тепла по сравнению с нагревом при P=cons’t.
-
Какие из приведенных ниже систем являются гомогенными и какие гетерогенными:
-
CO+H2O(r)
 CO2+H2;
CO2+H2; -
3GaJ(r)+1/2As4(r)
 2GaAs(T)+GaJ3(r);
2GaAs(T)+GaJ3(r); -
4GaAs(r)+2GaJ3
 6GaJ(r)+As4(r)?
6GaJ(r)+As4(r)?
Напишите выражение константы равновесия для приведенных систем. Как изменится скорость прямого и обратного процессов при увеличении давления в два раза? Будет ли наблюдаться смещение равновесия, в какую сторону? Выведите константу равновесия для реакции(2).
1,2- гетерофазные, т.к вещества не все в одной фазе.
3- гомофазные, т.к. вещества находятся в одной фазе.
-
CO+H2O
 CO2+H2
CO2+H2
K=![]()
-
3GaJ(r)+1/2As4(r)
 2GaAs(T)+GaJ3(r)
2GaAs(T)+GaJ3(r)
K=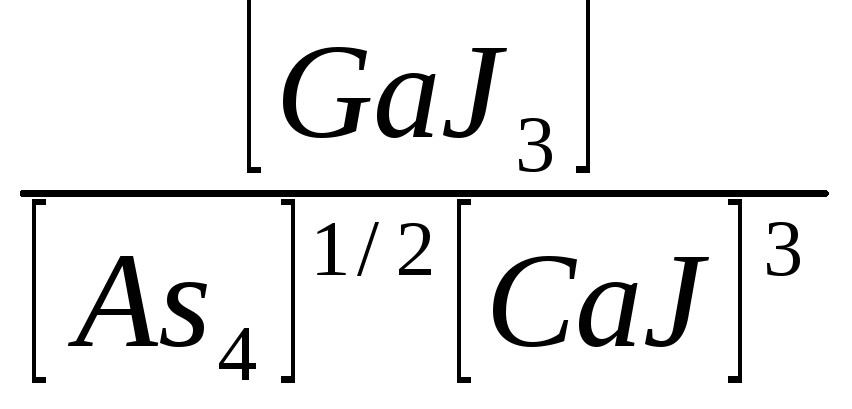
-
4GaAs(r)+2GaJ3
 6GaJ(r)+As4(r)
6GaJ(r)+As4(r)
K=
-
CO+H2O(r)
 CO2+H2
CO2+H2
![]()
![]()
![]()
![]()
Скорость прямой увеличивается в 4 раза, обратной в 2раза. Реакция смещена в сторону прямой реакции.
-
3GaJ(r)+1/2As4(r)
 2GaAs(T)+GaJ3(r)
2GaAs(T)+GaJ3(r)
![]()
![]()
![]() скорость прямой
реакции > скорости обратной.
скорость прямой
реакции > скорости обратной.
![]()
![]()
-
4GaAs(r)+2GaJ3
 6GaJ(r)+As4(r)
6GaJ(r)+As4(r)
![]()
![]()
Скорость прямой в 2 раза больше скорости обратной при повышении давления.
3GaJ(r)+1/2As4(r![]() )
2GaAs(T)+GaJ3(r)
)
2GaAs(T)+GaJ3(r)
![]()
![]()
![]()
k1![]()

-
Реакция выражается уравнением 4HCl+O2
 2H2O+2Cl2,
через некоторое время после начала
реакции концентрации участвующих в
ней веществ стали (моль/л):
2H2O+2Cl2,
через некоторое время после начала
реакции концентрации участвующих в
ней веществ стали (моль/л): Определите
равновесную концентрацию H2O,
исходные концентрации HCl
и O2.
Расчитайте Кс
и Кр
(T=500K).
Определите
равновесную концентрацию H2O,
исходные концентрации HCl
и O2.
Расчитайте Кс
и Кр
(T=500K).
4HCl+O2![]() 2H2O+2Cl2
2H2O+2Cl2
исход. a b - -
равн. a-4x b-x 2x 2x
![]() =0.30
x=0.15 CH2Op=2x=CCl2P=2*x=0.30
=0.30
x=0.15 CH2Op=2x=CCl2P=2*x=0.30
CHClp=a-4x=a-4*0.15=0.85
a=085+4*0.15=1.45
CO2p=b-x=0.44
b=0.44+0.15=0.59
исход. CO2=0.59 CHCl=1.45
равн. CН2O=0.30
kc=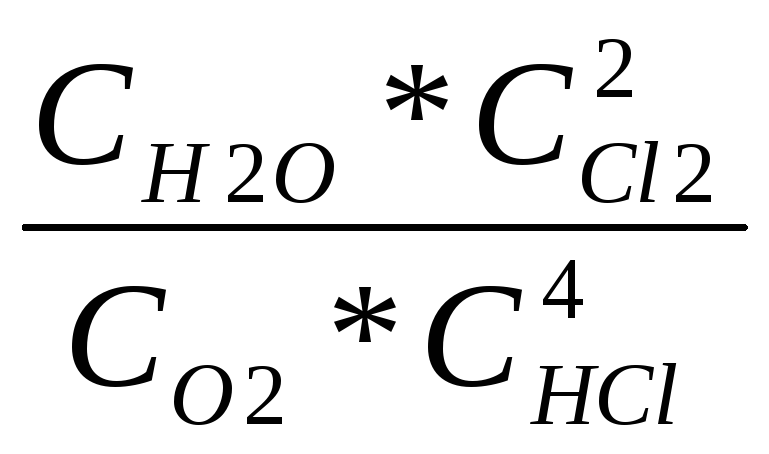
используем равновесные концентрации
kc=![]()
kp=kc(RT)[(c+d)-(a+b)]
В общем виде реакция:
a*A+b*B![]() c*C+d*D
c*C+d*D
kp=0.78(500*8.314)[(2+2)-(4+1)]=0.78*(4157)-1=1.9*10-4
-
Карбид кремния получают нагреванием до 2000
 смеси
песка и угля: SiO2(T)+3C(T)=SiC(T)+2CO(г)+122ккал.
Определить фазовый состав и число
степеней свободы.
смеси
песка и угля: SiO2(T)+3C(T)=SiC(T)+2CO(г)+122ккал.
Определить фазовый состав и число
степеней свободы.
В данной реакции фазовый состав таков: фаза газовая и твёрдая фаза, так как в результате реакции исходного вещества и продукты принадлежат двум фазам перечисленным выше.
Число степеней свободы- если влияют только t и Р, равно числу независимых компонентов системы минус число фаз плюс два:
Компонентов 4
С=К-Ф+2
С=4-2+2=4
-
Построить диаграмму состояния системы висмут-теллур (Bi-Te) по следующим данным:
|
Bi,вес % |
100 |
93 |
80 |
60 |
52 |
30 |
15 |
0 |
|
Т-ра появления кристалов,С |
271 |
250 |
400 |
540 |
570 |
480 |
398 |
430 |
По построенной диаграмме определить:
а) тип диаграммы и ее особенность;
б) чему равно число компонентов, число фаз и число степеней свободы в каждой из областей, ограниченных линиями диаграммы, на линиях;
в) определить процентный состав эвтектик и химического соединения;
г) поострить кривые охлаждения для сплавов, содержащих 0,20,30,80 и 100% висмута.
Сформируйте правило Гиббса, что называется фазой, компонентом, эвтектикой?
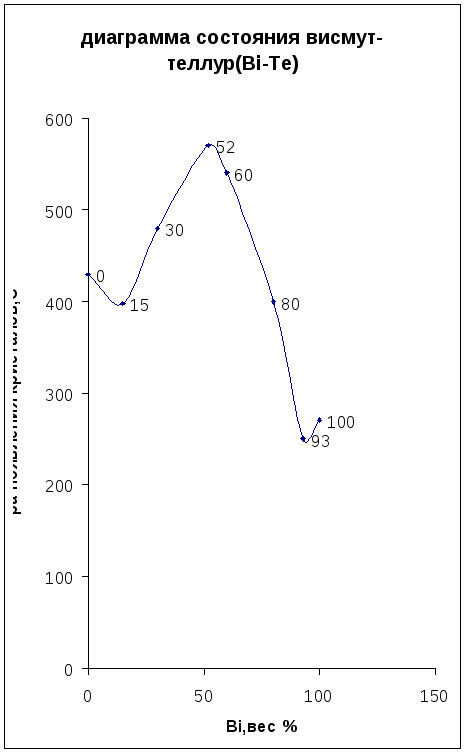
Диаграмма двухкомпонентной системы “Состав-свойство” характеризующаяся maximum, следует рассматривая диаграмму, можно говорить о том, что образуется химическое соединение в области максимума состава из Bi и Te , это указывается на диаграмме или в виде таблицы.
|
|
компонентов |
число фаз |
число степеней свободы |
|||
|
I |
1 |
L2 |
1 |
2 |
2 |
2 |
|
|
|
M3 |
|
2 |
|
3 |
|
II |
2 |
N2 |
2 |
2 |
2 |
2 |
|
III |
2 |
O2 |
2 |
2 |
2 |
2 |
|
IV |
2 |
α3 |
2 |
2 |
2 |
3 |
|
V |
2 |
S2 |
1 |
2 |
3 |
2 |
|
VI |
2 |
T3 |
1 |
2 |
3 |
3 |
С=[Ф(к-1)+2]-к(Ф-1)
48%-Te-1
52%-Bi-x x=1.1 TeBi1.1
Правило фаз Гиббса: Вариантность системы на равновесие который из внешних факторов влияют только р и Т равна числу независимых компонентов минус число фаз +2.
Фаза- часть неоднородной системы обладающих одинаковым составом и химическими свойствами. Компонент- часть системы которая может быть выделена из неё и существовать независимо. Эвтектика- совместная кристаллизация при самой низкой или высокой температуре.

